| Темы на форуме | Автор | Дата |
Общая характеристика.
Многие биологически активные молекулы включают несколько химически различных функциональных групп, способных к взаимодействию между собой или с функциональными группами других молекул. Один из примеров — моносахариды, в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных природных соединений — аминокислоты.
Аминокислоты - это органические бифункциональные соединения, в состав которых входят карбоксильная группа -СООН и аминогруппа -NН2. В зависимости от взаимного расположения обеих функциональных групп различают α-, β-, γ-аминокислоты:
β α β α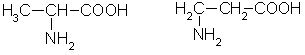
α-аминопропионовая β-аминопропионовая
кислота кислота
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Здесь будут рассматриваться только α-аминокислоты, поскольку другие аминокислоты в природе не встречаются.
В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Иминокислота пролин (молекулярная формула C5H9NO2) имеет структуру
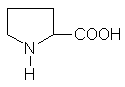
Простейшая аминокислота — глицин (аминоуксусная кислота). Остальные природные аминокислоты можно разделить на следующие основные группы:
α-Аминокислоты общей формулы
![]()
| Аминокислота |
Обозначение (трёх- и одно- буквенное) |
-R |
Молеку-лярная формула |
| Глицин |
Gly(G) |
-H |
C2H5NO2 |
|
Аланин |
Ala(A) |
-CH3 |
C3H7NO2 |
|
Валил |
Val(V) |
-CH(CH3)2 |
C5H11NO2 |
|
Лейцин |
Leu(L) |
-CH2-CH(CH3)2 |
C6H13NO2 |
|
Изолейцин |
Ile(I) |
-CH2-CH(CH3)-C2H5 |
C7H15NO2 |
|
Цистеин |
Cys(C) |
-CH2-SH |
C3H7SNO2 |
|
Метионин |
Met(M) |
-CH2-CH2-S-CH3 |
C5H11SNO2 |
|
Серин |
Ser(S) |
-CH2-OH |
C3H7NO3 |
|
Треонин |
Thr(t) |
-CH(OH)-CH3 |
C4H9NO3 |
|
Фенилаланин |
Phe(F) |
-CH2-C6H5 |
C9H11NO2 |
|
Тирозин |
Tyr(Y) |
|
C9H11NO3 |
|
Триптофан |
Trp(W) |
|
C11H12N2O2 |
|
Аспарагиновая кислота |
Asp(D) |
-CH2COOH |
C4H7NO4 |
|
Глутаминовая кислота |
Glu(E) |
-CH2-CH2-COOH |
C5H9NO4 |
|
Аспарагин |
Asn(N) |
-CH2-CO-NH2 |
C4H8N2O3 |
| Глутамин |
Gln(Q) |
-CH2-CH2-CO-NH2 |
C5H10N2O3 |
|
Гистидин |
His(H) |
|
C6H9N3O2 |
|
Лизин |
Lys(K) |
-(CH2)4-NH2 |
C6H14N2O2 |
|
Аргинин |
Arg(R) |
|
C6H14N4O2 |
1) гомологи глицина — аланин, валин, лейцин, изолейцин;
2) серосодержащие аминокислоты — цистеин, метионин;
3) аминокислоты с алифатической гидроксильной группой — серин, треонин;
4) ароматические аминокислоты — фенилаланин, тирозин, триптофан;
5) аминокислоты с кислотным радикалом — аспарагиновая и глутаминовая кислоты;
6) аминокислоты с амидной группой — аспарагин, глутамин;
7) аминокислоты с основным радикалом — гистидин, лизин, аргинин.
Изомерия. Физические свойства. Получение
Изомерия. Во всех α-аминокислотах, кроме глицина, α-углеродный атом связан с четырьмя разными заместителями, поэтому все эти аминокислоты могут существовать в виде двух изомеров (энантиомеров), являющихся зеркальными отражениями друг друга (оптическая изомерия). Каждый изомер относят к D- или L-ряду в зависимости от того, совпадает его конфигурация с конфигурацией D-глицеринового альдегида или нет:
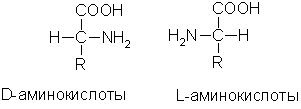
В состав белков животных организмов входят только L-аминокислоты.
Физические свойства. Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус.
Получение. Основной способ получения аминокислот — замещение атома галогена на аминогруппу в галогензамещенных кислотах. Этот способ аналогичен получению аминов из алкилгалогенидов иаммиака. Выделяющийся при замещении галогеноводород связывают избытком аммиака:
Cl-CH(R)-COOH + 2NH3 → H2N-CH(R)-COOH + NH4Cl.
Химические свойства
Аминокислоты - это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
Н2N-СН2-СООН + HCl→ Сl[Н3N-СН2-СООН],
Н2N-СН2-СООН + NaOH → H2N-CH2-COONa + Н2О.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
H2N-CH2—СООН ![]() +Н3N-СН2—СОO-.
+Н3N-СН2—СОO-.
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
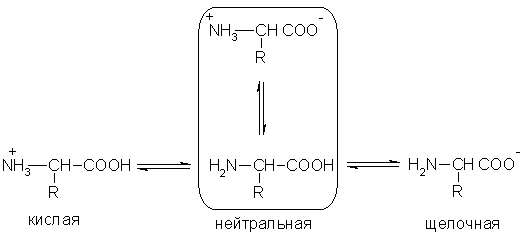
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин - щелочной (одна группа -СООН, две -NH2).
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H2N-CH(R)-COOH + R'OH ![]() H2N-CH(R)-COOR' + Н2О.
H2N-CH(R)-COOR' + Н2О.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Важнейшее свойство аминокислот — их способность к конденсации с образованием пептидов.
Качественные реакции.
1) Все аминокислоты окисляются нингидрином
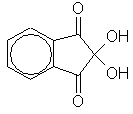
с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос — желтый).
Своё Спасибо, еще не выражали..
 admin
admin






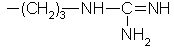

 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
