| Темы на форуме | Автор | Дата |
Строение
Белки — это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции.
Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка - это конкретная последовательность аминокислот в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве 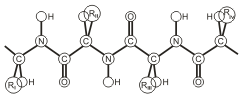
Вторичная структура - это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и СО. Существует два основных способа укладки цепи — α-спираль и β-структура 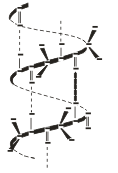
В α-спирали на одном витке укладывается четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями 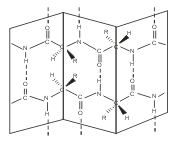
Большинство белков содержит как α-спирали, так и β-структуры.
Третичная структура белка — это трехмерная конфигурация закрученной α-спирали или β-структуры в пространстве.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп NН3+ и СОО- и гидрофобные взаимодействия, т.е. стремление молекулы белка свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры.
Третичная структура — высшая форма пространственной организации белков. Однако, некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями 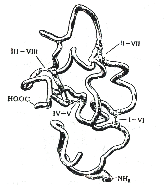 .
.
Ключевой этап определения структуры белка — расшифровка последовательности аминокислот в первичной структуре. Для этого белок сначала разделяют на полипептидные цепи (если их несколько), а затем анализируют аминокислотный состав цепей путем последовательного отщепления аминокислот. Это — чрезвычайно трудоемкая процедура, поэтому первичная структура надежно установлена только для достаточно простых белков.
Первый белок, у которого была расшифрована первичная структура, — гормон инсулин (1955 г.). Это — простой белок, состоящий из двух полипептидных цепей (одна цепь содержит 21 аминокислотный остаток, другая - 30 остатков), соединенных двумя дисульфидными мостиками  . На установление его структуры английскому биохимику Ф. Сангеру потребовалось 10 лет.
. На установление его структуры английскому биохимику Ф. Сангеру потребовалось 10 лет.

Пространственную структуру белков анализируют, изучая данные рассеяния рентгеновского излучения (рентгеноструктурный анализ) или нейтронов (нейтронография). Часто применяют также спектроскопические методы, особенно для исследования структуры белков в водных растворах.
Принципиальная возможность синтеза белков была доказана на примере двух гормонов — вазопрессина и окситоцина. Впоследствии были синтезированы более сложные белки — инсулин и рибонуклеаза (124 аминокислотных остатка).
Для синтеза белков широко используют твердофазный метод, разработанный в начале 1960-х гг. американским химиком Б.Меррифилдом. В этом методе первая аминокислота закрепляется на полимерном носителе, и к ней последовательно подшиваются новые аминокислоты. По окончании синтеза готовая полипептидная цепь отрывается от носителя.
В настоящее время искусственное получение белков осуществляется не с помощью химического, а с помощью микробиологического синтеза, путем использования микроорганизмов.
В живой природе синтез белков происходит чрезвычайно быстро, всего за несколько секунд. Живые клетки — это хорошо организованные «фабрики», в которых четко налажена система поставки сырья (аминокислот) и технология сборки. Информация о первичной структуре всех белков организма содержится в дезоксирибонуклеиновой кислоте (ДНК).
Свойства. Биологическое значение.
Физические свойства белков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы.
Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации - свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Для белков известны несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина) дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция).
Биологическое значение белков чрезвычайно велико. Упомянем только важнейшие функции белков в живых организмах.
1. Абсолютно все химические реакции в организме протекают в присутствии катализаторов — ферментов. Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой. Все известные ферменты представляют собой белковые молекулы. Белки — это очень мощные и, самое главное, селективные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой единственный фермент.
2. Некоторые белки выполняют транспортные функции и переносят молекулы или ионы в места синтеза или накопления. Например, содержащийся в крови белок гемоглобин переносит кислород к тканям, а белок миоглобин запасаеткислород в мышцах.
3. Белки — это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
4. Белки играют важную роль в иммунной системе организма.
Существуют специфические белки (антитела), которые способны распознавать и связывать чужеродные объекты - вирусы, бактерии, чужие клетки.
5. Белки-рецепторы воспринимают и передают сигналы, поступающие от соседних клеток или из окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Из приведенного перечня функций белков ясно, что белки жизненно необходимы любому организму и являются, следовательно, важнейшей составной частью продуктов питания. В процессе пищеварения белки гидролизуются до аминокислот, которые служат исходным сырьем для синтеза белков, необходимых данному организму. Существуют аминокислоты, которые организм не в состоянии синтезировать сам и приобретает их только с пищей. Эти аминокислоты называются незаменимыми. Для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин,лизин, метионин и фенилаланин.
Своё Спасибо, еще не выражали..
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
