| Темы на форуме | Автор | Дата |
Задача 1. Имеется 148 г смеси двух органических соединений одинакового состава С3Н6О2. Определите строение этих соединений и их массовые доли в смеси, если известно, что одно из них при взаимодействии с избытком гидрокарбоната натрия выделяет 22,4 л (н.у.) оксида углерода (IV), а другое не реагирует с карбонатом натрия и аммиачным раствором оксида серебра, но при нагревании с водным раствором гидроксида натрия образует спирт и соль кислоты.
Задача 2. Относительная плотность паров сложного эфира по водороду равна 44. При гидролизе этого эфира образуются два соединения, при сгорании равных количеств которых образуются одинаковые объемы углекислого газа (при одинаковых условиях). Приведите структурную формулу этого эфира.
Задача 3. При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если известно, что серебряная соль кислоты содержит 59,66% серебра по массе. Спирт Б не окисляется дихроматом натрия и легко реагирует с хлороводородной кислотой с образованием алкилхлорида.
Задача 4. Напишите две возможные формулы жира, имеющего в молекуле 57 атомов углерода и вступающего в реакцию с иодом в соотношении 1:2. В составе жира имеются остатки кислот с четным числом углеродных атомов.
 admin
admin

Мыла - это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли - жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
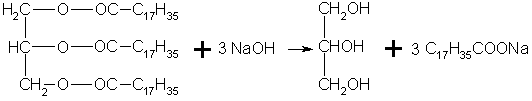
 admin
admin

Жиры являются сложными эфирами, образованными высшими одноосновными карбоновыми кислотами, главным образом пальмитиновой, стеариновой (насыщенные кислоты) и олеиновой (ненасыщенная кислота) и трехатомным спиртом - глицерином. Общее название таких соединений - триглицериды
Природные жиры представляют собой не индивидуальное вещество, а смесь различных триглицеридов.
Образование одного из триглицеридов, например триглицерида стеариновой кислоты, можно изобразить уравнением
 admin
admin

 admin
admin

Задача 1. Как в две стадии из уксусного альдегида получить бромэтан?
Задача 2. Соединение состава С4Н8Сl2 с неразветвленным углеродным скелетом нагрели с водным раствором гидроксида натрия и получили органическое соединение, которое при окислении гидроксидом меди (II) превратилось в соединение состава С4Н8О2. Определите строение исходного соединения.
Задача 3. Для каталитического гидрирования 17,8 г смеси муравьиного и уксусного альдегидов до соответствующих спиртов потребовалось 11,2 л водорода (н.у.). Определите массовые доли альдегидов в смеси.
Задача 4. Определите структурную формулу соединения, если известно, что оно состоит из 37,7% С, 6,3% Н и 56,0% Cl (по массе). 6,35 г паров этого соединения занимают объем 1,12 л (н.у.). При гидролизе этого соединения образуется вещество, состоящее из С, Н, О, а при восстановлении последнего образуется вторичный спирт.
Задача 5. К 1,17 г смеси прогтанола-1 и неизвестного альдегида добавили аммиачный раствор 5,80 г оксида серебра и слегка нагрели. Выпавший при этом осадок отфильтровали, а непрореагировавший оксид серебра перевели в хлорид серебра, масса которого оказалась равной 2,87 г. Определите строение взятого альдегида, если молярное отношение альдегида к спирту в исходной смеси равно 3:1.
 admin
admin

Получение.
1. Гидратация алкинов. Из ацетилена получается альдегид, из его гомологов — кетоны :
Hg2+, H+
СH≡СН + Н2О → СН3-СН=О.
Hg2+, H+
СН3-С≡СН + Н2О → СН3-СО-СН3.
Из-за своей относительной дороговизны, а также из-за того, что получаемые соединения загрязнены токсичными соединениями ртути, в настоящее время этот способ находит ограниченное применение.
 admin
admin

Органические соединения, в молекуле которых имеется карбонильная группа > С=О, называются карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы — альдегиды и квтоны. В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом:
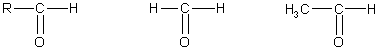
альдегиды формальдегид ацетальдегид
(муравьиный альдегид)(уксусный альдегид)
а в молекулах кетонов — с двумя углеводородными радикалами:
![]()
кетоны ацетон метилэтилкетон
(диметилкетон)
 admin
admin

Задача 1. Определите строение ароматического углеводорода состава С9Н12, если известно, что при его окислении перманганатом калия образуется бензолтрикарбоновая кислота, а при бромировании в присутствии FeBr3 - только одно монобромпроизводное.
Задача 2. При действии бромной воды на антраниловую (2-аминобензойную) кислоту получена смесь моно- и дибромпроизводных. Напишите структурные формулы каждого из полученных изомеров.
Задача 3. Предложите схему получения 3-нитробензойной кислоты из этилбензола в две стадии. Укажите условия реакций.
Задача 4. Выход нитробензола при нитровании монодейтеробензола равен а%. Как изменится значение выхода продукта замещения дейтерия на нитрогруппу, если в opтo-положение к дейтерию ввести нитрогруппу? Напишите уравнения упомянутых реакций.
Задача 5. При окислении смеси бензола и толуола подкисленным раствором перманганата калия при нагревании получено 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объем которого в 19 раз меньше объема такого же газа, полученного при полном сгорании исходной смеси углеводородов. Определите массы веществ в исходной смеси.
 admin
admin

Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только s-связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
Влияние заместителей, передающееся по сопряженной системе p-связей, называется мезомерным (М) эффектом.
В молекуле бензола p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют +М и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа -ОН и аминогруппа -NH2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредотачивается в орто- и пара-положениях.
 admin
admin

Свойства. Бензол - бесцветная, летучая, огнеопасная жидкость со своеобразным запахом. В воде практически нерастворим. Горит сильно коптящим пламенем. Пары бензола с воздухом образуют взрывчатую смесь. Жидкий бензол и пары бензола ядовиты. При обычных условиях большинство ароматических углеводородов также представляют собой бесцветные жидкости, нерастворимые в воде, обладающие характерным запахом.
По химическим свойствам бензол и другие ароматические углеводороды отличаются от предельных и непредельных углеводородов. Наиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путем получают множество органических соединений.
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
