| Темы на форуме | Автор | Дата |
Задача 1. Как в две стадии из уксусного альдегида получить бромэтан?
Задача 2. Соединение состава С4Н8Сl2 с неразветвленным углеродным скелетом нагрели с водным раствором гидроксида натрия и получили органическое соединение, которое при окислении гидроксидом меди (II) превратилось в соединение состава С4Н8О2. Определите строение исходного соединения.
Задача 3. Для каталитического гидрирования 17,8 г смеси муравьиного и уксусного альдегидов до соответствующих спиртов потребовалось 11,2 л водорода (н.у.). Определите массовые доли альдегидов в смеси.
Задача 4. Определите структурную формулу соединения, если известно, что оно состоит из 37,7% С, 6,3% Н и 56,0% Cl (по массе). 6,35 г паров этого соединения занимают объем 1,12 л (н.у.). При гидролизе этого соединения образуется вещество, состоящее из С, Н, О, а при восстановлении последнего образуется вторичный спирт.
Задача 5. К 1,17 г смеси прогтанола-1 и неизвестного альдегида добавили аммиачный раствор 5,80 г оксида серебра и слегка нагрели. Выпавший при этом осадок отфильтровали, а непрореагировавший оксид серебра перевели в хлорид серебра, масса которого оказалась равной 2,87 г. Определите строение взятого альдегида, если молярное отношение альдегида к спирту в исходной смеси равно 3:1.
 admin
admin

Получение.
1. Гидратация алкинов. Из ацетилена получается альдегид, из его гомологов — кетоны :
Hg2+, H+
СH≡СН + Н2О → СН3-СН=О.
Hg2+, H+
СН3-С≡СН + Н2О → СН3-СО-СН3.
Из-за своей относительной дороговизны, а также из-за того, что получаемые соединения загрязнены токсичными соединениями ртути, в настоящее время этот способ находит ограниченное применение.
 admin
admin

Органические соединения, в молекуле которых имеется карбонильная группа > С=О, называются карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы — альдегиды и квтоны. В молекулах альдегидов карбонильная группа связана с атомами водорода или с одним углеводородным радикалом:
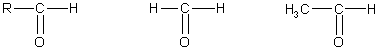
альдегиды формальдегид ацетальдегид
(муравьиный альдегид)(уксусный альдегид)
а в молекулах кетонов — с двумя углеводородными радикалами:
![]()
кетоны ацетон метилэтилкетон
(диметилкетон)
 admin
admin

Задача 1. Определите строение ароматического углеводорода состава С9Н12, если известно, что при его окислении перманганатом калия образуется бензолтрикарбоновая кислота, а при бромировании в присутствии FeBr3 - только одно монобромпроизводное.
Задача 2. При действии бромной воды на антраниловую (2-аминобензойную) кислоту получена смесь моно- и дибромпроизводных. Напишите структурные формулы каждого из полученных изомеров.
Задача 3. Предложите схему получения 3-нитробензойной кислоты из этилбензола в две стадии. Укажите условия реакций.
Задача 4. Выход нитробензола при нитровании монодейтеробензола равен а%. Как изменится значение выхода продукта замещения дейтерия на нитрогруппу, если в opтo-положение к дейтерию ввести нитрогруппу? Напишите уравнения упомянутых реакций.
Задача 5. При окислении смеси бензола и толуола подкисленным раствором перманганата калия при нагревании получено 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объем которого в 19 раз меньше объема такого же газа, полученного при полном сгорании исходной смеси углеводородов. Определите массы веществ в исходной смеси.
 admin
admin

Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только s-связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
Влияние заместителей, передающееся по сопряженной системе p-связей, называется мезомерным (М) эффектом.
В молекуле бензола p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют +М и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа -ОН и аминогруппа -NH2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредотачивается в орто- и пара-положениях.
 admin
admin

Свойства. Бензол - бесцветная, летучая, огнеопасная жидкость со своеобразным запахом. В воде практически нерастворим. Горит сильно коптящим пламенем. Пары бензола с воздухом образуют взрывчатую смесь. Жидкий бензол и пары бензола ядовиты. При обычных условиях большинство ароматических углеводородов также представляют собой бесцветные жидкости, нерастворимые в воде, обладающие характерным запахом.
По химическим свойствам бензол и другие ароматические углеводороды отличаются от предельных и непредельных углеводородов. Наиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путем получают множество органических соединений.
 admin
admin

При замещении в молекуле бензола одного атома водорода на радикал винил образуется винилбензол, или стирол: С6H5-CH=CH2.
Стирол - бесцветная жидкость с приятным запахом, легче воды, кипит при 145°С. Сохраняет свойства непредельных углеводородов: обесцвечивает бромную воду и раствор перманганата калия (за счет двойной связи в винильном радикале).
Стирол очень легко полимеризуется, образуя полистирол. Особенно ценна его способность к совместной полимеризации с бутадиеном, в результате которой получают различные сорта бутадиенстирольных каучуков (жаро- и морозоустойчивые, прочные на износ, высокоэластичные, устойчивые к маслам). Из них изготовляют шины, ленты для транспортеров, эскалаторов, облегченную микропористую подошву и др.
 admin
admin

Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.
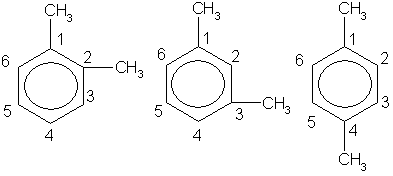
 admin
admin

Ароматическими называются соединения, в молекуле которых имеется циклическая группа атомов с особым характером связи - ядро бензола. Международное название ароматических углеводородов - арены.
Простейшим представителем аренов является бензол С6Н6. Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком Кекуле (1865):
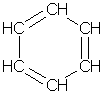
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
 admin
admin

Задача 1. С помощью каких химических реакций можно очистить пропан от примеси пропена?
Задача 2. Этиленовый углеводород массой 7,0 г присоединяет 2,24 л (н.у.) бромоводорода. Определите молярную массу и строение этого углеводорода, если известно, что он является цис-изомером.
Задача 3. Сколько существует индивидуальных веществ состава С3Н5Сl. обесцвечивающих бромную воду? Приведите структурные формулы молекул этих веществ.
Задача 4. При взаимодействии 11,2 л (н.у.) смеси изомерных углеводородов, представляющих собой газы с плотностью по водороду 21, с бромной водой получено 40,4 г соответствующего дибромпроизводного. Определите строение этих углеводородов и содержание каждого из них в смеси (в % по объему).
Задача 5. При пропускании алкена через избыток раствора перманганата калия масса выпавшего осадка оказалась в 2,07 раза больше массы алкена. Установите формулу алкена.
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
