| Темы на форуме | Автор | Дата |
Почти все важнейшие части орудий производства, начиная простейших механизмов и кончая сложными машинами, изготовлены из металлов. Хотя широко используемые в последнее время пластмассы частично заменяют металлы, производство металлов все время возрастает, и в будущем все равно главным образом из них будут изготовлять большинство промышленных установок, машины, моторы, электрическую проводку, котлы высокого давления и т. д.
Перечислим некоторые характерные свойства металлов: металлы можно отливать, ковать, вальцевать, вытягивать в проволоку, гнуть, сваривать, паять, обтачивать, сверлить, пилить, строгать.
Сплавляя металлы или вводя в них небольшие добавки неметаллов, можно получать материалы, отвечающие специальным требованиям.
Инструменты для обработки металлов (токарные резцы, сверла, специальные пилы и т. д.) должны обладать повышенной твердостью, а листовые или винтовые рессоры, напротив, отличаться эластичностью и одновременно прочностью. От зубчатых колес, валов, болтов и гаек требуется особенная прочность на излом, от тросов и цепей — чрезвычайное сопротивление растяжению, а колбам, цилиндрам, котлам высокого давления приходится переносить высокую температуру, огромное давление и воздействие химически агрессивных веществ.
Без металлов не было бы электротехники. Хорошая проводимость электрического тока характерна для всех «настоящих металлов» и не присуща неметаллическим материалам. Из более чем 90 химических элементов, встречающихся в природе, около 65 причисляют к металлам. Некоторые элементы, такие как сурьма или полупроводник германий, стоят на границе между металлами и неметаллами.
Еще 200 лет назад большая часть этих металлов не имела никакого технического значения. Довольствовались обычными, в основном легко получаемыми, металлами. Только с наступлением атомного века, при постройке сверхзвуковых самолетов и космических ракет, требования к металлическим материалам резко повысились. Уже в начале прошлого века потребности авиационной промышленности привели к развитию производства легких металлов: алюминия и магния. Многочисленные изобретения сделали возможным создание установок для получения таких металлов, названия которых сравнительно недавно были известны немногим. Это прежде всего титан и цирконий, которые встречаются часто, но в основном рассеяны в горных породах и редко встречаются в виде чистых руд. Техническое значение приобрели также бериллий, гафний, индий, ниобий и другие экзотические металлы.
Уран и плутоний служат сегодня горючим для ядерных реакторов, в которых получают тонны трансуранового элемента плутония.
Плутоний можно назвать искусственным элементом — в природе он практически не встречается. В результате ядерного расщепления 1 кг плутония выделяется примерно столько же энергии, как при сгорании 2500т каменного угля или при взрыве такого же количества тринитротолуола!
 admin
admin

По экспериментальной химии металлов и их соединений можно было бы написать объемистую книгу. До сих пор, изучая с помощью несложных опытов некоторые свойства металлов и их солей, мы в лучшем случае могли сделать многосторонний, но несистематический и далеко не полный обзор. Теперь уделим особенное внимание распределению металлов по группам и важнейшим свойствам этих групп. Далее мы рассмотрим реакции, по которым можно установить наличие определенного металла в смеси веществ.
Для этих опытов нам понадобятся образцы чистых металлов или их сплавов, которые можно изготовить из старых металлических предметов. Токарная стружка и металлические опилки, остатки медной проволоки, старые никелевые и серебряные монеты, алюминиевая фольга и испорченные хромированные части велосипеда, цинковая пластинка из использованной батарейки для карманного фонарика, кусок старого водосточного желоба, свинец из аккумуляторной пластины или из остатка кабеля, оловянная фольга или оловянные фигурки, вольфрамовая пить накаливания из перегоревшей лампочки, молибденовый держатель нити накаливания или сетка использованной радиолампы, никелевый анод этой же лампы — вот некоторые, далеко не полные возможности для заготовки металлических образцов. Само собой разумеется нам потребуются очень небольшие количества дорогих цветных металлов, которые надо постараться извлечь из металлолома.
Наряду с этими образцами воспользуемся также соединениями металлов, которые можно приобрести, так же как и другие химикаты, в аптеке, хозяйственном магазине, в специализированном магазине реактивов и т. д.
В химии металлы классифицируют по их положению в периодической системе элементов. Практики, кроме того, подразделяют металлы на тяжелые и легкие, благородные и неблагородные, тугоплавкие и легкоплавкие, а также классифицируют их с других точек зрения.
Периодическая система состоит, как известно, из групп, которые в свою очередь включают в себя главные и побочные подгруппы элементов, обладающих схожими химическими свойствами, в таблице они расположены друг под другом. В главной подгруппе первой группы находятся щелочные металлы — литий, калий, натрий, рубидий и цезий, а в побочной подгруппе первой группы — медь, серебро и золото. В главную подгруппу второй группы включены щелочноземельные металлы бериллий, магний, кальций, стронций, барий, радий, а в побочную — цинк, кадмий и ртуть. Третья группа начинается с неметалла бора, затем идут металлы, образующие «земли»: алюминий, скандий, иттрий, 15 редкоземельных элементов и радиоактивный актиний. В соответствующей побочной подгруппе находятся мало известные металлы галлий, индий и таллий. В главных подгруппах четвертой и пятой групп металлический характер обнаруживают только последние члены группы, а в главных подгруппах шестой, седьмой и восьмой групп находятся только неметаллы. Но элементы побочных подгрупп этих групп периодической системы являются металлами. Особенно важны так называемые переходные металлы побочной подгруппы восьмой группы, которые образуют три подгруппы. Здесь содержатся металлы подгруппы железа и платины. Разделение на группы можно объяснить с помощью атомной теории, но здесь это было бы излишним.
 admin
admin

Щелочные металлы (главная подгруппа I группы) → Химия / Практическая химия / Металлы - основа техники
Щелочные металлы химически очень активны и бурно реагируют с водой, в результате чего образуются сильные основания. С солями щелочных металлов калия и натрия мы уже познакомились.
Аналитически обнаружить эти металлы сложно, так как они не образуют нерастворимых солей при взаимодействии с наиболее употребимыми кислотами, поэтому реакции осаждения возможны лишь со сложными реагентами. Не известны также характерные цветные реакции с простыми реагентами в нерастворенном или твердом состоянии. По окраске пламени натрием и калием их можно обнаружить качественно.
 admin
admin

В несветящемся пламени бунзеновской горелки будем держать палочки магнезии до тех пор, пока не исчезнет начальная окраска пламени. Затем нанесем на палочку чуть-чуть поваренной соли и опять поместим ее в пламя, которое окрасится в яркий желтый цвет. Так как окраска очень интенсивна, а натрий является почти непременной примесью в солях, всегда следует убедиться, сравнивая полученную окраску пламени с окраской пламени чистого соединения натрия, находится ли элемент в виде примеси или в виде основного компонента.
Калий окрашивает пламя в красно-фиолетовый цвет. Чтобы избавиться от мешающего желтого цвета, в который окрашивает пламя присутствующий тут же натрий, воспользуемся голубым фильтром (кобальтовым стеклом). Таким образом можно проверить содержание калия в некоторых солях. При наличии небольшого количества солей лития можно наблюдать окрашивание этим элементом пламени в чудесный красный цвет.
 admin
admin

В противоположность щелочным металлам, медь, серебро и золото очень инертны. Они обладают незначительным сродством к кислороду, их оксиды очень легко восстанавливать и металлы встречаются в природе в элементарной форме (золото чаще всего). Благородный характер металлов усиливается от меди к серебру, а от него — к золоту. Для остальных побочных групп периодической системы также существует правило, что с увеличением порядкового номера элемента убывает его активность. Разбавленными кислотами металлы побочной подгруппы I группы не разрушаются. Но медь и серебро растворяются в сильной азотной кислоте, а золото в царской водке (смесь одной объемной части азотной и трех частей соляной кислоты).
Общими свойствами щелочных металлов и металлов подгруппы меди являются их одновалентность во многих соединениях, а также отличная электропроводность, Правда, иногда медь и серебро могут быть двухвалентными, а золото может образовывать даже трехвалентные соединения.
 admin
admin

В несветящееся пламя бунзеновской горелки внесем пинцетом кусочек медной проволоки. Медь начнет интенсивно окисляться: сначала на поверхности появятся цвета побежалости, затем медь окрасится в черный цвет, так как образуется слой оксида меди (П) СuО. При обычной температуре очень быстро возникает слой красного оксида меди (I) CuО, который постоянно существует на поверхности.
Если внести окисленную медь в восстановительную зону пламени бунзеновской горелки (верхняя часть конуса), то оксид восстановится водородом, и мы увидим, что чистый металл красного цвета.
Летучие соединения меди окрашивают пламя в зеленый цвет. В этом мы убедимся, если погрузим медную проволоку в соляную кислоту и затем внесем ее в несветящуюся часть пламени. В этом случае образуется некоторое количество летучего хлорида меди СuСl2, который и окрашивает пламя.
Тонкая медная проволока плавится в несветящемся пламени бунзеновской горелки при 1084 °С. Чтобы нагреть больший кусок меди до этой температуры, нужно применить стеклодувную горелку.
Любую соль меди можно легко восстановить до металлической меди, если расплавить ее с содой на древесном угле с помощью паяльной трубки. Смешаем очень малое количество безводного сульфата меди с безводной содой в соотношении 1:3 и внесем смесь в углубление па кусочке древесного угля. (Обе соли высушим, прокаливая содержащие воду кристаллы в пробирках из тугоплавкого стекла или в фарфоровых тиглях на пламени бунзеновской горелки.) Затем направим на смесь восстановительное пламя паяльной лампы. Через некоторое время охладим смесь и обнаружим в углублении красные крупинки металлической меди.
 admin
admin

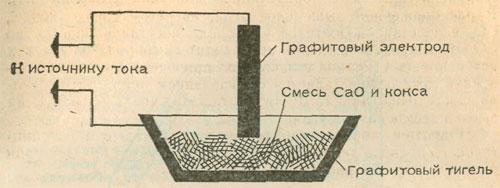
В химическом кружке при наличии маленькой электродуговой печи, а также требуемого источника тока можно получить немного карбида кальция. В маленький графитовый тигель или в углубление, выдолбленное в толстом угольном электроде, поместим смесь равных (по массе) количеств оксида кальция (негашеной извести) и кусочков кокса размером с булавочную головку. Избыточный уголь при действии кислорода воздуха сгорит. Схема опыта показана на рисунке.
 admin
admin

Докажем присутствие в этине (ацетилене) ненасыщенной связи с помощью реактива Байера или бромной воды. Для этого поместим реактив в пробирку и пропустим через него этин. Его мы получим в другой пробирке из нескольких кусочков карбида кальция. Эту пробирку закроем резиновой пробкой с двумя отверстиями. В одно из них заранее вставим стеклянную трубку с изогнутым концом - он должен быть погружен в пробирку с реактивом. В другое отверстие вставим капельную воронку и кран ее вначале закроем. Можно взять вместо нее и простую стеклянную воронку, заменив кран зажимом, как при получении метана. В воронку нальем воду неосторожно приоткрывая кран, будем медленно, по каплям, добавлять ее к карбиду.
 admin
admin

Система прежде всего! Вступая в мир органической химии, можно сразу же заблудиться, если предварительно не ознакомиться с классами органических соединений и основами языка органической химии. В самом деле, ведь большинство органических веществ можно разделить на группы со сходным строением и подобными свойствами. Химики, используя латинские и греческие корни, и, кроме того, в значительной мере выдуманную ими абракадабру, создали такую хорошо продуманную систему названий, которая сразу же подсказывает специалисту, к какому классу следует отнести те или иные вещества.
Одна беда: наряду с названиями по единым правилам международной номенклатуры для многих соединений до сих пор употребляются их собственные названия, связанные с происхождением этих соединений, их наиболее примечательными свойствами или другими факторами. Поэтому для многих соединений в этой книге придется приводить несколько названий.
Мы уже знакомы с насыщенными и ненасыщенными углеводородами. Насыщенные углеводороды называются алканами, ненасыщенные с двойной связью — алкенами, и с тройной — алкинами. Нам известно, что эти углеводороды, если расположить их в порядке увеличения числа атомов углерода, образуют гомологические ряды.
Наряду с углеводородами большое значение имеют такие органические соединения, которые содержат еще кислород. Рассмотрим сначала три ряда кислородсодержащих органических соединений:
алканолы (спирты)
алканали (альдегиды)
алкановые кислоты (прежнее название — карбоновые кислоты)
 admin
admin

При сухой перегонке древесины мы уже получили несколько капель неочищенного метанола (метилового спирта). В настоящее время подавляющая часть метанола получается путем синтеза из водяного газа:
СО + 2Н2 ↔ СН3ОН
Составные части водяного газа соединяются с образованием метанола. Кроме того, в незначительном количестве образуются и высшие спирты. Этот процесс требует температуры 400 °С, давления 200 ат и ускоряется в присутствии оксидных катализаторов.
Метанол служит растворителем и промежуточным продуктом в производстве красителей. Но главным потребителем его является производство пластмасс, для которого нужны большие количества метаналя (формальдегида). Метаналь же получается при окислении метанола кислородом воздуха. В промышленности смесь паров метанола и воздуха при 400 °С пропускают над медным или серебряным катализатором.
Чтобы смоделировать этот процесс, согнем в спираль кусочек медной проволоки диаметром 0,5—1 мм и щипцами внесем его в несветящуюся зону пламени горелки Бунзена.
Проволока раскаляется и покрывается слоем оксида меди (II). Поместим полученный нами раньше метанол (10 капель) в достаточно широкую пробирку и опустим в него раскаленную медную спираль.
Вследствие нагревания метанол испаряется и под влиянием катализатора — меди — соединяется с кислородом с образованием метаналя (мы узнаем его по характерному резкому запаху). При этом поверхность медной проволоки восстанавливается. Реакция происходит с выделением тепла. При больших количествах паров метанола и воздуха медь остается разогретой до тех пор, пока реакция не завершится. Отметим, что метанол очень ядовит! Поэтому не будем проводить опыт с большими количествами. Даже маленький глоток метанола может вызвать полную потерю зрения, а иногда и смерть.
Поэтому метанол всегда нужно хранить так, чтобы ни в коем случае никто не мог по сшибке выпить его. Впрочем, метанол наряду с другими соединениями специально добавляют в малом количестве к спирту, который используется для горения, с целью его денатурации. Поэтому денатурированный спирт тоже ядовит!
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
