| Темы на форуме | Автор | Дата |
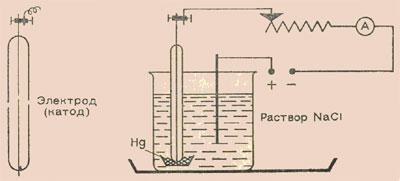
С самого начала надо привыкать работать с малыми количествами веществ (это экономит химикаты и время и приучает к точности). Поэтому выберем несколько небольших сосудов, применяемых, например, для полумикроанализа. Возьмем маленькие фарфоровые тигли (высотой 1,5 см). В один из них нальем немного ртути. Затем поставим его в химический стакан на 50 мл, который на 3/4 наполним концентрированным раствором поваренной соли. Стакан поставим в плоскую чашку или кювету. Теперь нужны два электрода. Анод должен быть графитовый, так как на нем выделяется химически активный хлор. Воспользуемся угольным стержнем от батарейки для карманного фонарика или сделаем графитовый стержень. Катодом может служить вязальная спица, которую надо заплавить в стеклянную трубку так, чтобы с одной стороны торчал кончик длиной 1,5— 2 мм. Этим концом погрузим катод в ртуть (стеклянная трубка также должна смачиваться ртутью).
Теперь можно включить цепь постоянного тока. Удобнее всего работать с напряжением 12 В (аккумулятор), поддерживая в течение 3—5 мин ток 1 А. Работайте без страха, ведь так же протекает процесс в батарее карманного фонарика! Конечно, в цепь желательно ввести переменное сопротивление и амперметр. Мы заметим, что на угольном стержне образуются мелкие пузырьки газа, в котором легко узнать хлор — и по запаху, и с помощью влажной крахмальной бумажки, смоченной иодидом калия (посинение). На катоде, если ртуть чистая, ничего не наблюдается.
 admin
admin

Другая часть едкого натра получается в промышленности по диафрагменному способу. Пористая перегородка — диафрагма — должна полностью исключить перемешивание жидкости катодного и анодного пространства, но не мешать передвижению ионов. В промышленности в качестве диафрагм применяют асбестовый картон, асбестовую бумагу или пропитанную сульфатом бария асбестовую вату. Иногда диафрагму получают также из портланд-цемента и раствора поваренной соли. Если после затвердевания цемента провести выщелачивание, то кристаллы соли растворятся, и, таким образом, возникнут мелкие поры.
Для нашего опыта с успехом может быть применена отбитая с одного конца яичная скорлупа. Промоем ее вначале разбавленной соляной кислотой, а затем — многократно водой. Подвесим скорлупу в держателе из толстой изолированной проволоки на стенку не слишком маленького химического стакана и заполним скорлупу и стакан концентрированным раствором поваренной соли. В яйцо погрузим анод — угольный стержень, а в качестве катода используем железную проволоку, свернутую спиралью.
Примерно через пять минут после начала электролиза, проводимого при напряжении 6—12 В и токе 0,5—1 А, отберем первую пробу и проверим основность среды, как мы это делали в предыдущем опыте.
Еще через пять минут прекратим опыт. Из катодного пространства возьмем примерно 20 мл полученной щелочи, а к остатку добавим: каплю раствора фенолфталеина. Интенсивная красная окраска — показатель успешного опыта. Если капнуть фенолфталеин в скорлупу, цвет не изменится, зато растворы иодида калия и крахмала окрасятся в голубой цвет.
В технике 10—15 %-ный раствор едкого натра выпаривают в вакуумных аппаратах. При упаривании выпадает твердый хлорид натрия, который отделяют фильтрованием.
 admin
admin

Теперь займемся хлором, который получается при электролизе раствора поваренной соли. Но имеющегося у нас количества мало для дальнейших опытов. Поэтому надо получить газ из других соединений хлора. Самым подходящим и дешевым исходным веществом является соляная кислота.
Получим хлор
Эрленмейеровскую колбу на 250 мл закроем пробкой с двумя отверстиями. В одно вставим капельную воронку, в другое — согнутую под прямым углом газоотводную трубку. На дно колбы положим несколько кристалликов перманганата калия, а капельную воронку до середины заполним концентрированной соляной кислотой. Когда соляная кислота будет капать на перманганат калия, образуется желто-зеленый газ, он постепенно наполнит колбу и затем начнет проходить через трубку.
Перманганат калия КМnO4 (калиевая соль марганцевой кислоты HМnО4) является сильным окислителем. Он окисляет до воды содержащийся в соляной кислоте водород и освобождает хлор:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
В качестве окислителей можно применить также оксид марганца (IV) МnО2 (пиролюзит) или бихромат калия К2Сr2О7.
Хлор — сильный яд! Он раздражает слизистые оболочки, поражает дыхательные пути и при длительном вдыхании приводит к смерти в результате разрушения легких. Поэтому опыты с хлором нужно проводить обязательно в вытяжном шкафу или на открытом воздухе.
Избыток хлора можно связать, пропуская его через концентрированные растворы щелочей, с которыми он реагирует по следующему уравнению:
2NaOH+Cl2 → NaClO + NaCl + H2O
Для связывания остатка хлора применяется также раствор тиосульфата (гипосульфита) натрия Na2S2O3.
 admin
admin

Заполним хлором несколько больших пробирок, для этого подведем в них сверху газ, используя опущенную на дно сосуда трубку. Хлор в 2,5 раза тяжелее воздуха, поэтому он полностью вытеснит последний из пробирки.
В первую пробирку поместим зеленые листочки и цветы разной окраски, в другую — несколько полосок голубой и красной лакмусовой бумаги, несколько цветных лоскутков материи, а также влажный лист бумаги, на котором сделаны надписи простым карандашом, чернилами и разноцветными химическими карандашами. Закроем пробирки корковыми пробками и оставим на некоторое время. Части растений, лакмусовая бумага, следы карандаша (кроме простого), а также некоторые окрашенные лоскутки ткани обесцветятся.
Дело в том, что при взаимодействии хлора с водой в испытываемых объектах происходит реакция:
Н2О+С12 → НС1О + НС1
Хлорноватистая кислота НС1О, которая образуется наряду с соляной кислотой, полностью разлагается с выделением чрезвычайно реакционноспособного атомарного кислорода:
НС1О → НС1 + O
Ему в конечном счете и следует приписать отбеливающий эффект.
Отбеливающие средства на основе хлора часто применяются в текстильной промышленности, а дезинфицирующие — для обеззараживания воды. Хлор может отбелить также жиры и масла.
Насыплем в заполненную хлором пробирку порошок железа (0,25—0,5 г), который предварительно нагреем на железном шпателе или на полоске жести. Железный порошок взаимодействует с хлором с появлением пламени, В результате образуется хлорид железа (III):
2Fe + 3Cl2 → 2FeCl3
Если опыт не удался, значит, хлор был влажный. Для того чтобы его высушить, пропустим через промывную склянку с концентрированной серной кислотой.
Другие металлы (цинк, медь, олово и т. д.) тоже взаимодействуют с хлором, образуя соответствующие хлориды. Эти реакции дали повод назвать хлор и родственные ему элементы — фтор, бром и иод — галогенами, что в переводе означает «рождающий соль».
 admin
admin

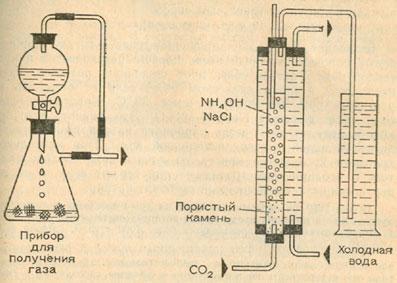
Для синтеза нам нужны два аппарата для получения газов. В одном будем получать водород из разбавленной серной кислоты и цинка, а в другом — хлор из соляной кислоты и перманганата калия. Пропустив оба газа через концентрированную серную кислоту, высушим их и затем, сжигая водород в атмосфере хлора, получим хлористый водород.
Закроем ламповое стекло или широкий стеклянный цилиндр двумя пробками с двумя отверстиями в каждой (см. рисунок). В одно из отверстий в нижней пробке вставим согнутую под прямым углом трубку для подвода хлора, второе — диаметром не менее 10 мм — закроем пробкой. В отверстия в верхней пробке вставим кусок стеклянной трубки, на которую надет шланг с зажимом, и согнутую под прямым углом трубку, которую отведем в сосуд с водой. Оттуда полученный газ будет поступать в сосуд с раствором тиосульфата натрия. Прежде всего заполним цилиндр хлором (второе нижнее отверстие плотно закрыто!). В это время получим в аппарате Киппа водород. Еще раз напоминаем: его необходимо высушить, пропустив через концентрированную серную кислоту.
Укрепим на промывной склянке кусок шланга длиной не менее 20 см и вставим в конец шланга стеклянную трубку с оттянутым носиком, на которую надета пробка, точно соответствующая диаметру широкого отверстия. Если проба на гремучий газ дала отрицательный результат, то подожжем водород, выходящий из оттянутого конца стеклянной трубки. Тем временем цилиндр наполнится хлором. Удалим маленькую пробку и быстро (чтобы не зажечь резину) вставим трубку с пламенем водорода на конце.
Обратим внимание на то, чтобы оба газа поступали в цилиндр с одинаковой скоростью. Водород сгорает в атмосфере хлора с появлением бледного пламени. В результате образуется хлористый водород, который мы можем обнаружить, если откроем верхний зажим и подержим перед отверстием шланга стеклянную палочку, смоченную гидроксидом аммония — образуется туман нашатыря. Если пламя начинает угасать, необходимо немедленно перекрыть подачу водорода, так как в цилиндре образуется чрезвычайно взрывоопасный хлористоводородный гремучий газ. (Цилиндр хорошо проветрить!) Это опасный опыт, и его можно проводить только под руководством специалиста.
Газообразный хлористый водород растворяется в первой промывной склянке (абсорбере), в результате получается соляная кислота.
Проверим наличие кислой среды с помощью лакмуса, а хлорид-ионы обнаружим, добавив нитрат серебра. По окончании реакции сначала надо прекратить подачу водорода, а затем отсоединить цилиндр от абсорбера. Если этого не сделать, то вода потечет из абсорбера в цилиндр, так как хлористый водород чрезвычайно хорошо растворяется в воде (1 объемная часть воды растворяет при комнатной температуре около 450 объемных частей хлористого водорода).
Хлористый водород мы можем получить также при взаимодействии хлорида натрия и концентрированной серной кислоты:
2NaCl + H2SO4 → Na2SO4 + 2HCl
а затем провести с ним опыт с образованием фонтана.
 admin
admin

Еще в давние времена были известны стекло и мыло. Для их изготовления применяли карбонат натрия (соду), который добывали на берегах содовых озер в Африке и Америке или получали из золы морских и прибрежных растений на побережьях Европы. Примерно 150 лет назад соду стали производить химико-технологическим методом. Первый процесс изготовления соды разработал француз Леблан. Но с 1870 г. более рентабельный способ бельгийца Сольве стал вытеснять метод Леблана, и в 1916 г. закрылась последняя фабрика, работающая по этому методу.
Сода имеет исключительно важное значение для народного хозяйства. Она используется в производстве моющих и очищающих средств, в стекольной и текстильной промышленности. В металлургии ее применяют для удаления серы из железа и стали; сода используется в производстве силиката натрия, фосфатов, селитры и алюминия, эмалей, смоляных красок и в фармацевтической промышленности. В соде нуждаются кожевенная, резиновая, сахарная промышленность, производство продуктов питания, фотопринадлежностей, она является необходимым компонентом при очистке воды.
В районах Магдебурга и Галле в достаточном количестве имеются исходные продукты для производства соды — известь, поваренная соль, уголь и вода. Предприятие им. Карла Маркса в Бернбурге является центром производства соды в ГДР.
Два простых химических уравнения воспроизведут реакции, протекающие в многочисленных технологических установках. Сначала из аммиака, диоксида углерода и воды получают гидрокарбонат аммония NН4НСО3, который при взаимодействии с раствором поваренной соли даст в результате гидрокарбонат натрия NaHCO3 и хлорид аммония NH4C1:
NaCl + NH4HCO3 → NaHCO3 + NH4C1
Выпадает плохо растворимый гидрокарбонат натрия, его отделяют фильтрованием, а в результате прокаливания (кальцинирования) он переходит в карбонат натрия:
2NaHCO3 → Na2CO3 + Н2О + CO2↑
Особенно рентабельным делает процесс регенерация аммиака и частично диоксида углерода.
 admin
admin

Для этого опыта применим аппарат, в котором при небольшом давлении получим диоксид углерода (углекислый газ). Подсоединим к газоотводной трубке этого аппарата Т-образную трубку, одно колено которой свяжем с капельной воронкой.
 admin
admin

Нет кислоты, которая была бы нужнее и применялась бы чаще, чем серная. Главным образом ее применяют в качестве полуфабриката; многочисленные предприятия по производству серной кислоты перерабатывают ее далее в различных процессах.
Почти половину всей производимой в Германии серной кислоты (это составляет около полумиллиона тонн в год) потребляют две отрасли хозяйства: производство синтетических волокон и суперфосфата.
Серная кислота также необходима для получения красителей, взрывчатых веществ, средств для консервирования, ядохимикатов, медикаментов и моющих средств.
Почти всем предприятиям металлургической и горнодобывающей промышленности серная кислота необходима для обогащения руд. В промышленности концентрированную серную кислоту используют для сушки газов (нам это также известно из лабораторных опытов), а из нефти с помощью серной кислоты можно удалить примеси. Наконец, серная кислота служит электролитом в свинцовых аккумуляторах.
Неслучайно перспективные планы развития химической промышленности каждой страны предусматривают увеличение производства серной кислоты и числа требующихся для этого многочисленных установок.
В настоящее время серную кислоту получают па 13 предприятиях Гурмании. Самыми известными среди них являются химический комбинат в Биттерфельде, предприятия по производству серной кислоты и суперфосфата в Косвиге, завод в Магдебурге, свинцовоплавильный завод во Фрайберге, комбинат им. Вильгельма Пика в Мансфельде и, наконец, предприятия по производству искусственных волокон и искусственного шелка в Шварце и Премнице. В стране работают три установки, построенные польскими специалистами. Производство серной кислоты па душу населения составляет в более 60 кг в год.
 admin
admin

Сера широко распространена на Земле. Многочисленные залежи серы в свободном состоянии находятся в Мексике, Польше, на острове Сицилия, в США, СНГ и Японии. Залежи серы в Польше — вторые в мире, они оцениваются в 110 млн. т и почти не уступают мексиканским. Месторождения в Польше были полностью оценены только в 1951 г., разработка началась в 1957 г. В 1970 г. добыто уже 2,6 млн. т, а затем годовая добыча достигла 5 млн. т.
Сера входит в состав различных минералов; ее можно обнаружить в морской воде в виде сульфатов. Растительные и животные организмы содержат связанную в белке серу; в угле, который образуется из растений, встречается сера, связанная в органических соединениях или в виде соединений с железом (серный колчедан FeS2). Бурый уголь может содержать до 6 % серы. Угольноперерабатывающая промышленность Германии при очистке коксового, водяного и генераторного газа ежегодно получает 100000 т серы.
 admin
admin

Пары серы взаимодействуют с раскаленным углем с образованием дисульфида углерода CS2 (сероуглерода), огнеопасной жидкости с неприятным запахом. Он незаменим при производстве искусственного шелка и штапеля. Сера, которая, как известно, не растворяется в воде и в незначительных количествах растворяется в бензоле, спирте или эфире, прекрасно растворяется в сероуглероде.
Если медленно испарять на часовом стекле раствор небольшого количества серы в сероуглероде, то получим крупные кристаллы так называемой ромбической или α-серы. Но не будем забывать об огнеопасности и ядовитости сероуглерода, поэтому потушим все горелки и поставим часовое стекло под тягу или перед окном.
Другая форма — моноклинная или β-сера получится, если терпеливо выкристаллизовывать из толуола иглы длиной около 1 см (толуол также огнеопасен!).
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
