| Темы на форуме | Автор | Дата |
В наши дни органические растворители можно найти в любом доме. Кому не приходилось пятновыводителем удалять пятна жира или смолы с одежды? Все лаки, многие клеи, например резиновый, также содержат различные органические растворители. При наличии некоторого опыта можно уже по запаху сказать, какое именно вещество служит в этих смесях растворителем.
Органические растворители требуются почти на любом производстве. Жиры и масла извлекают из растений растворителями. Производство пластмасс, текстильная и лакокрасочная промышленность потребляют растворители в огромных количествах. Так же обстоит дело в производстве лекарственных препаратов и косметики, во многих других отраслях хозяйства.
С некоторыми главными растворителями, например бензином и спиртом, многим наверняка приходилось встречаться. При оценке растворителя играют роль многие факторы. Прежде всего, конечно, важно, какие вещества в нем хорошо растворяются. Так, в спирте прекрасно растворяются многие смолы, лекарственные и косметические средства, тогда как жиры и парафин растворяются в нем очень плохо. Кроме того, при сопоставлении растворителей существенную роль играют их горючесть, температура кипения, токсичность и, не в последнюю очередь, стоимость.
Следующие опыты проведем с несколькими соединениями, которые особенно часто применяются в качестве растворителей.
 admin
admin

Если в метане все четыре атома водорода заместить хлором, то получится тетрахлорметан (четыреххлористый углерод).
Тетрахлорметан представляет собой жидкость, которая кипит при 76 °С и имеет плотность 1,593 г/см3. Таким образом, он намного тяжелее воды и почти не смешивается с ней. Тетрахлорметан превосходно растворяет смолы, жиры и т. д. и имеет перед другими растворителями большое преимущество: он не горит. Напротив! Его тяжелые пары подавляют пламя, благодаря этому его используют в огнетушителях.
Нальем в чашку немного бензина, спирта или ацетона и на открытом воздухе осторожно подожжем эту горючую жидкость. Если мы добавим теперь несколько миллилитров тетрахлорметана, то огонь погаснет. Следует учесть, что при гашении техрахлорметаном может образоваться очень ядовитый газ фосген СОСl2. Поэтому в закрытых помещениях это средство для тушения огня можно применять только с соответствующими предосторожностями. В последнее время заряженные тетрахлорметаном огнетушители выходят из употребления. Вместо него в огнетушителях теперь применяются смешанные бром-хлор- или фтор-хлорпроизводные углеводородов.
В следующем опыте смешаем 2 мл тетрахлорметана с 1,5 г цинковой пыли. Последняя представляет собой очень мелкий порошок, который получается при конденсации паров цинка. К смеси добавим еще столько жженой магнезии или оксида цинка, чтобы получилась паста средней вязкости. Поместим ее на кусок листового железа или в железный тигель и на открытом воздухе нагреем на голом огне до 200 °С. При этом начинается бурная реакция, приводящая к повышению температуры смеси выше 1000 °С. Одновременно выделяется густой дым. Тетрахлорметан и цинк реагируют с образованием хлорида цинка:
2Zn + CCl4 → 2ZnCl2 + C
Хлорид цинка при высокой температуре испаряется и образует туман, притягивая воду из воздуха.
Другие металлы, особенно железо, тоже медленно реагируют с тетрахлорметаном. Поэтому он способствует коррозии и не годится в качестве растворителя лаков для металла и тому подобных целей.
Тетрахлорметан довольно ядовит. Вдыхание его паров в малых дозах оказывает наркотическое действие, а в больших дозах или при так называемом хроническом отравлении приводит к тяжелым поражениям печени. Поэтому при работе с тетрахлорметаном нужна осторожность. Надежная вентиляция исключит накопление паров тетрахлорметана в воздухе.
 admin
admin

Следующим важным представителем группы растворителей является пропанон (ацетон).
При сухой перегонке древесины мы получили кальциевую соль уксусной кислоты — «серый древесноуксусный порошок». Тот, кто не проводил этого опыта, легко может приготовить указанную соль путем нейтрализации разбавленного раствора уксусной кислоты (столового уксуса) карбонатом или гидроксидом кальция.
Для получения ацетона поместим несколько граммов древесноуксусного порошка в пробирку из тугоплавкого стекла. Пробирку закроем резиновой пробкой, в отверстие которой вставлена изогнутая стеклянная трубка. Эту трубку охладим с помощью свинцового змеевика. Приемником может служить пробирка, погруженная в ледяную воду. Из-за огнеопасности продукта отводная трубка должна быть не слишком короткой, чтобы расстояние между пламенем и приемником было как можно больше. Кроме того, учтем, что опыт можно проводить только в вытяжном шкафу или на открытом воздухе.
Сильно нагреем пробирку с порошком горелкой Бунзена. Выделяются пары, и в приемнике конденсируется подвижная жидкость, которая в зависимости от степени чистоты исходной соли имеет окраску от желтой до коричневатой. Она состоит, главным образом из ацетона, применяемого в качестве растворителя жиров:
 admin
admin

В заключение рассмотрим эфир, который, помимо его применения в медицине для наркоза, является прекрасным растворителем для жиров и многих других веществ.
Строго говоря, существуют различные простые эфиры, которые так же, как алканали или алканоны, образуют класс соединений со сходными свойствами. Обычный эфир строго должен называться диэтиловым эфиром. Он образуется из двух молекул этанола путем отщепления воды, обычно с помощью концентрированной серной кислоты:
2СН3СН2ОН → (СН3СН2)2О + Н2О
Получим малое количество эфира. Для этого в пробирку нальем около 2 мл денатурата и 1,5 мл концентрированной серной кислоты.
Подберем к пробирке пробку с двумя отверстиями. В одно из них вставим маленькую капельную воронку или просто маленькую воронку с удлиненной трубкой, выход из которой вначале закроем с помощью кусочка резинового шланга и зажима. Используя второе отверстие в пробке, присоединим к пробирке устройство для охлаждения паров —такое же, как и при получении этаналя. Приемник надо непременно охлаждать водой со льдом, потому что эфир кипит уже при 34,6 °С!
Ввиду его необычайно легкой воспламеняемости, холодильник должен быть как можно длиннее (не меньше 80 см), чтобы между источником огня и приемником было достаточное расстояние.
 admin
admin

Углеродный скелет органических соединений, которые мы рассматривали до сих пор, представлял собой прямые или разветвленные цепи. Немецкий химик Август Кекуле впервые открыл, что молекулы многих других органических соединений построены по типу кольца. Важнейшее кольцо (циклическое соединение углерода) —бензол — содержится в количестве 1—2 % в каменноугольной смоле, из которой его и получают.
Бензол — бесцветная жидкость, которая кипит при 80,2 °С и затвердевает при 5,5 °С. Для того, кто хранит свои реактивы в неотапливаемом помещении, замерзание бензола — признак того, что пора найти место потеплее для склянок с водными растворами, чтобы они не раскололись, когда начнет замерзать вода.
Бензол очень огнеопасен! Поместим несколько капель его на часовое стекло и осторожно поднесем горящую спичку. Бензол воспламенится раньше, чем пламя соприкоснется с жидкостью. Он горит коптящим пламенем, что указывает на высокое содержание углерода. Брутто-формула бензола — С6Н6. Таким образом, соотношение углерода и водорода у него такое же, как у этина. Действительно, бензол образуется из трех молекул этина при пропускании последнего через раскаленную железную или кварцевую трубку. Но мы ни в коем случае не будем проводить эту реакцию самостоятельно из-за опасности взрыва, который произойдет при попадании в трубку воздуха.
Несмотря на сходство в составе бензола и этина, их химические свойства совершенно различны. Применив бромную воду или реактив Байера, мы легко докажем, что бензол не вступает в реакции, типичные для ненасыщенных соединений. Очевидно, это обусловлено его особым строением. Кекуле предложил для бензола формулу, которая содержит три двойных связи в шестичленном кольце. Однако в соответствии с новыми представлениями устойчивое строение бензола лучше объясняется тем, что «избыточные» валентные электроны, как показано в формуле, приведенной посередине, принадлежат всему кольцу, образуя единое «электронное облако»:
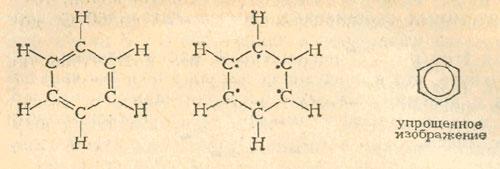
Производные бензола, которых сейчас уже известно несколько сотен тысяч, образуются при введении в кольцо функциональных групп, а также в результате присоединения к бензольному кольцу дополнительных колец или углеродных боковых цепей. В следующих опытах мы получим и исследуем некоторые из простейших и одновременно важнейших в технике производных бензола.
 admin
admin

В отличие от углеводородов с открытой цепью, у которых это очень затруднительно, в ароматические углеводороды легко можно ввести нитрогруппу NO2.
Для получения нитробензола нам понадобятся вначале 15 мл бензола, 20 мл концентрированной серной кислоты и 15 мл концентрированной азотной кислоты, а в конце опыта— вода и разбавленный едкий натр. Бензол очень ядовит; ни в коем случае нельзя вдыхать его пары.
Прежде всего, подготовим все необходимое оборудование. Подберем колбу Эрленмейера вместимостью 125 мл с резиновой пробкой, в отверстие которой вставлена не слишком тонкая стеклянная трубка длиной около 50 см. Нам понадобятся также делительная воронка (вместимостью 150 мл), водяная баня и термометр со шкалой до 100 °С. Подготовим еще две кастрюли — одну с ледяной водой, а другую с водой, нагретой до 60 °С.
Ввиду опасности попадания брызг в глаза, этот опыт — как и всегда при работе с концентрированными кислотами — можно проводить только в защитных очках!
В колбу Эрленмейера поместим сначала концентрированную серную кислоту и потом очень осторожно, все время слегка покачивая колбу, малыми порциями добавим азотную кислоту. Разогретую нитрующую смесь охладим, погрузив колбу в холодную воду. Затем вставим в колбу термометр и начнем постепенно добавлять бензол, непрерывно перемешивая жидкость в колбе стеклянной палочкой. Температура при этом не должна превышать 50—60 °С. Если она поднимется выше, то перед добавлением следующей порции бензола необходимо выдержать колбу в ледяной воде. Когда весь бензол будет добавлен, колбу с вертикально вставленной трубкой выдержим еще некоторое время в бане с теплой водой, температуру которой будем поддерживать от 50 до 60°С, добавляя при необходимости более горячую воду.
После этого перенесем содержимое колбы в делительную воронку. Мы обнаружим два слоя: верхний слой содержит нитробензол, а нижний — избыточную нитрующую смесь. Сольем эту смесь кислот, добавим в делительную воронку около 30 мл воды, сильно встряхнем и отделим нитробензол, который теперь, вследствие своей большой плотности, образует уже нижний слой. Для дальнейшей очистки его надо таким же образом промыть сильно разбавленным раствором едкого натра и в заключение еще раз водой.
Нитробензол — бледно-желтая жидкость с температурой кипения 210 °С и плотностью 1,203 г/см3 при 20 °С. Если во время опыта мы допустим чрезмерное повышение температуры, нитробензол будет окрашен сильнее из-за примеси динитробензола. Нитробензол очень ядовит. Нужно также остерегаться вдыхания его вредных паров с характерным сильным запахом горького миндаля. Хотя такой аромат нужен в парфюмерии, применять для этого нитробензол категорически запрещено из-за его токсичности. Обычно с той же целью используется безопасный бензальдегид, имеющий такой же запах.
 admin
admin

Нитробензол для нас — так же, как и для химической промышленности — только промежуточный продукт. Мы тоже двинемся дальше и получим из него путем восстановления анилин — родоначальник синтетических красителей.
Чтобы получить аминогруппу NHa, мы должны в нитро-группе заместить кислород водородом. В промышленности нитробензол в настоящее время восстанавливают обычно в газовой фазе, пропуская его пары в смеси с водородом над медным катализатором. Мы, работая с малыми количествами, предпочтем более старый способ, при котором восстановление осуществляется в жидкой фазе водородом в момент выделения — на латыни это называется in statu nascendi. Для этого получим водород действием соляной кислоты на железные опилки или, лучше, на гранулированный цинк или олово.
При попадании нитробензола на кожу пораженное место нужно обмыть спиртом, а затем теплой водой с мылом.
Проведем опыт следующим образом. В колбу Эрленмейера — такую же, как при получении нитробензола — поместим 10 г нитробензола и 15 г железных опилок или гранулированного цинка. Вначале добавим 5 мл концентрированной соляной кислоты и тотчас закроем колбу пробкой, в которую вертикально вставлена стеклянная трубка. При осторожном встряхивании начнется бурная реакция. При этом колба разогревается, и ее надо охладить умеренно холодной водой — так, чтобы реакция все же не остановилась совсем. Время от времени будем вынимать пробку с трубкой и добавлять еще 5—8 мл соляной кислоты.
Когда мы добавим всего 50 мл соляной кислоты, подождем, пока реакция затихнет, и в вытяжном шкафу или на открытом воздухе будем греть колбу с той же стеклянной трубкой на водяной бане от 30 минут до часа.
В заключение разбавим реакционную смесь водой и для нейтрализации кислоты добавим раствор кальцинированной или питьевой соды (бикарбоната натрия) до щелочной реакции. Для этого смесь из колбы перенесем в химический стакан и прильем сначала воду, а затем — указанный раствор. Выделится коричневая жидкость со своеобразным запахом. Это и есть анилин, который можно отделить осторожной декантацией. Лучше, хотя и хлопотнее, выделить его перегонкой с водяным паром.
Внимание! Анилин — очень сильный яд, который положено хранить только закрытым и с надписью «яд». При работе с анилином нужно остерегаться вдыхания его паров. Лучше всего — так же, как и диэтиловый эфир, — хранить анилин только в виде разбавленного спиртового раствора.
Анилин послужил исходным веществом для производства первых синтетических органических красителей. Очень давно Рунге открыл первый анилиновый краситель, который и сейчас еще используется для обнаружения анилина.
Несколько капель анилина смешаем с 10 мл воды и добавим отфильтрованный водный раствор хлорной извести. Интенсивное фиолетовое окрашивание объясняется образованием красителя, сложное строение которого явилось трудной головоломкой даже для химиков XX века. Сохраним анилин для следующих опытов и заметим в заключение, что большинство красителей в наши дни получают не из анилина, а из других соединений.
 admin
admin

Из других производных бензола упомянем здесь только фенол, толуол и нафталин. Фенол тоже был впервые обнаружен Рунге в каменноугольной смоле. Он представляет собой ароматическое соединение с гидроксильной группой и, следовательно, подобен алканолам. Однако, в отличие от алканолов, фенол имеет слабокислую реакцию и легко взаимодействует со щелочами с образованием фенолятов. Поэтому его можно растворять в щелочах. Мы уже получили родственные ему крезолы при сухой перегонке древесины и полукоксовании бурого угля. Это можно доказать, добавив к вытяжке древесного дегтя или буроугольной смолы и подсмольной воде раствор хлорида железа (III). Фенол и родственные ему вещества дают при этом окраску от синей до сине-фиолетовой. Правда, для вытяжек смолы и дегтя эта окраска может маскироваться их собственной коричневой окраской.
Чистый фенол — твердое вещество, которое плавится при 40,8 °С и кипит при 182,2 °С. При 16 °С он растворяется в 12 частях воды, причем полученный раствор окрашивает лакмусовую бумажку в красный цвет. (Проверить!) В свою очередь, фенол тоже растворяет в себе некоторое количество воды и становится жидким, даже когда в нем растворено только 5 % воды! Если мы добавим к твердому фенолу воду, то получим сначала жидкий раствор воды в феноле, а при дальнейшем добавлении воды — раствор фенола в воде.
В связи с ростом производства пластмасс фенол стал одним из важнейших промежуточных продуктов химической промышленности. Мировое производство его сейчас, по-видимому, достигает почти 200000 т в год. В Германии значительное количество фенола получается при полукоксовании бурого угля. Кроме того, все больше фенола производится путем синтеза.
 admin
admin

50 г отрубей поместим в коническую или круглодонную колбу и смешаем их со 150 мл 10—15 %-ного раствора серной кислоты. Отгоним из колбы около 100 мл жидкости. В ней содержится около 1 г растворенного фурфурола. Извлечем его из дистиллята эфиром или тетрахлорметаном и органический растворитель упарим в вытяжном шкафу. Далее проведем только две простые качественные реакции.
В первом опыте к пробе полученного раствора добавим несколько капель соляной кислоты и немного анилина. Уже на холоду возникает ярко-красная окраска.
В следующем опыте к исследуемому раствору снова добавим соляную кислоту и несколько крупинок флороглюцина (это трехатомный фенол). При кипячении появится вишнево-красная окраска.
При кипячении с разбавленными кислотами определенные типы сахаров — пентозы — образуют фурфурол. Пентозы содержатся в отрубях, соломе и т. д. и могут быть обнаружены приведенными выше методами.
 admin
admin

Нашей планете уже около 5 миллиардов лет. Вначале она, вероятно, была раскаленным газовым шаром. Позднее в результате конденсации газов возникли металлы, камень, а потом и вода. К этому времени лишь некоторые газы окружали Землю, образуя ее первоначальную атмосферу. Однако прошло несколько миллиардов лет, а планета все еще был мертва. Только около миллиарда лет назад из неживой материи появились простейшие формы жизни.
В те далекие времена в атмосфере не было чистого кислорода, но было много углекислого газа (диоксида углерода). Растения — точно так же, как и теперь — строили из него и из влаги, содержащейся в почве, сложные соединения углерода. При этом в атмосферу выделялся свободный кислород. Так постепенно образовалась современная атмосфера, содержащая много кислорода и очень мало углекислого газа.
Соединения углерода, которые накапливались в растениях ранних эпох, большей частью подверглись превращениям под влиянием анаэробных бактерий. Из остатков отмерших растений образовались торф и каменный уголь. Этому процессу способствовало высокое давление минеральных отложений, которые постепенно осаждались на остатках растений. Движение земной коры, связанное с образованием гор, также благоприятствовало появлению угля, поскольку при этом повышались давление и температура. Признаки обильного и повсеместного растительного покрова нашей планеты особенно отчетливо обнаруживаются в каменном угле той эпохи, которая началась приблизительно 400 миллионов лет назад и длилась около 55 миллионов лет. Разумеется, эти растения отличались от современных.
Судя по отпечаткам на каменном угле, в лесу тогда преобладали гигантские папоротники и плауны. По остаткам в современных образцах угля можно получить ясное представление о растительном и животном мире того времени.
Нефть и природный газ возникали на дне огромных озер и морей, где было необычайно много водорослей и водных животных. Погибая, они погружались на дно и без доступа воздуха, под влиянием бактерий превращались в гниющий ил. При гниении выделялся ядовитый сероводород, губительно действующий на остальные живые организмы. Из органических веществ возникали вначале жирные кислоты, а позднее — нефть и природный газ.— Особенно благоприятными условиями для таких процессов отличался пермский период палеозойской эры. Именно с тех пор существуют многие из крупных месторождений нефти.
На территории, где в наши дни находится ГДР, не образовалось больших запасов каменного угля и нефти. Небольшие запасы угля обнаружены в Цвиккау и Фрейтале вблизи Дрездена. Нефть и природный газ удалось найти лишь в последние годы в результате планомерного бурения скважин в Тюрингии, Бранденбурге и Меклеибургс. Управление народных предприятий нефтяной промышленности в Стендале получило задание освоить эти, хотя и не очень богатые, но все же выгодные месторождения.
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
