| Темы на форуме | Автор | Дата |
Алгоритм составления названия органических веществ.
- Выбрать самую длинную углеродную цепь. Она определит название.
- Пронумеровать атомы углерода в этой цепи с того края, к которому ближе разветвление. Если радикалов несколько и они равноудалены от концов главной цепи, то нумеруют с того края, к которому ближе радикал, имеющий более простое строение.
- Обведите радикалы. Цифрой укажите, при каком атоме углерода находится радикал. Назовите их, начиная с простейшего. Если один и тот же радикал встречается несколько раз, используйте приставку ди-, три-, тетра- соответственно.
 admin
admin

Алгоритм решения задач на вывод формулы вещества
- Обозначить формулу вещества с помощью индексов х, у, z и т. д. по числу элементов в молекуле.
- Найти молярную или молекулярную массу вещества по формуле: Мr = Dх· Мr(Х), Мr = ρ· Vm.
- Если в условии не дана массовая доля одного элемента, вычислить ее как разность 100% и массовых долей всех остальных элементов.
- Найти отношение индексов х : у : z как отношение частных от деления массовой доли элемента на его относительную атомную массу (W/Аr). Привести частные от деления к отношению целых чисел. Определить простейшую формулу вещества.
- В задачах на нахождение формул органических веществ часто требуется сравнить относительную молекулярную массу М простейшей формулы с истинной, найденной по условию задачи (чаще всего плотности по воздуху или по водороду). Отношение этих масс дает число, на которое надо умножить индексы простейшей формулы.
Пример. Углеводород, плотность паров которого по водороду равна 15, содержит 80,0% углерода. Найдите его молекулярную формулу.
Дано. Решение. W(С) = 80% 1. Обозначим формулу углеводорода CXHY
DH2(в-ва) = 15 2. Рассчитаем относительную молекулярную массу углеводорода: Мr = Dх· Мr(Х),
Мк(СхНу ) = 2 • DH2 (в-ва) = 2 • 15 = 30
3. Вычислим массовую долю водорода в соединении:
Формула W(Н) = 100% - W(С) = 100% - 80,0% = 20,0%.
CXHY— ? 4. Найдем отношение индексов х : у: С:Н = x:у = W(C) : Ar(C) / W(H) : Ar(H)
С:Н = х:у = := 6,67 : 20 = 1:3 Простейшая формула соединения СН3.
Сравним относительную молекулярную массу истинного в-ва с относительной молекулярной массой простейшей формулы:
МГ(СН3) =12 + 3 = 15,
Мr{СхHу) = = 2
Выяснили, что число атомов обоих элементов в простейшей формуле надо увеличить в два раза.
Истинная формула вещества С2Н6.
 admin
admin

Пример 1. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза. Пишем уравнение диссоциации соли: CuSO4 = Cu2+ + .
«Правило цепочки»: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита.
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду: Cu2+ + H–OH CuOH+ + H+.
Образуется катион гидроксомеди(II) и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два. Получаем:
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4.
 admin
admin

Азотная кислота
HNO3
O
H — O –N
O
Получение азотной кислоты:
1) В лаборатории: NaNO3 + H2SO4 = NaHSO4 + HNO3
2) В промышленности: N2 ® NO ® NO2 ® HNO3
Химические свойства азотной кислоты:
Чем ниже концентрация кислоты и активнее металл (выше восстановительная способность), тем ниже степень окисления азота в продуктах реакции (+4, +2, +1, 0, -3)
 admin
admin

Задача 1. Этиленовый углеводород присоединяет 6,72 л (н.у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метильные группы. Определите строение исходного углеводорода и полученного спирта.
Задача 2. Соединение неизвестного строения медленно реагирует с натрием, не окисляется раствором дихромата натрия, с концентрированной соляной кислотой реагирует быстро с образованием алкилхлорида, содержащего 33,3% хлора по массе. Определите строение этого соединения.
Задача 3. Расположите в порядке возрастания кислотности следующие вещества: фенол, сернистая кислота, метанол. Приведите уравнения химических реакций, подтверждающие правильность выбранной последовательности.
Задача 4. При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидроксида калия (плотность 1,4 г/мл). Определите массовые доли веществ в исходной смеси.
Задача 5. Среди изомеров состава С7Н7ОK выберите такой, из которого в две стадии можно получить соединение состава С7Н6ОВr2.
 admin
admin
 Химия, Биология, Строение, Смеси, Кислота, Щелочь, Реакции, натрий, Калий, Фенол, Спирт
Химия, Биология, Строение, Смеси, Кислота, Щелочь, Реакции, натрий, Калий, Фенол, Спирт
 admin
admin

Важнейшие из многоатомных спиртов - этиленгликоль и глицерин:
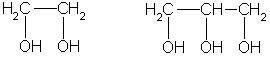
этиленгликоль глицерин
Это — вязкие жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях.
Получение.
1. Гидролиз алкилгалогенидов (аналогично одноатомным спиртам):
ClCH2-CH2Cl + 2NaOH → НОСН2-СН2ОН + 2NaCl.
 admin
admin

 admin
admin

Задача 1. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти углеродных атомов, и назовите их.
Задача 2. При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси.
Задача 3. Как химическим путем выделить бутин-2 из его смеси с бутином-1?
Задача 4. Эквимолярная смесь ацетилена и формальдегида полностью прореагировала с 69,6 г оксида серебра (аммиачный раствор). Определите состав смеси (в % по массе).
Задача 5. Дихлоралкан, в котором атомы хлора находятся у соседних атомов углерода, обработали избытком спиртового раствора щелочи. Масса выделившегося газа оказалась в 2,825 раза меньше массы исходного дихлоралкана. Установите строение исходного соединения и продукта реакции.
 admin
admin

Физические свойства алкинов похожи на свойства алканов и алкенов. При обычных условиях (С2 – С4) — газы, (C5 – C16) — жидкости, начиная с C17 — твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов. Так, этилен имеет tкип = -103 °С, ацетилен кипит при -83,6 °С; пропен и пропин соответственно при -47 °С и -23 °С.
Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях.
Получение. 1. Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
| С2Н5ОН | ||
| СН2Вr - СН2Вr + 2КОН | → | НС ≡ СН + 2КВr + 2Н2О, |
| С2Н5ОН | |||
| СН3 - СВr2 - СН3 + 2КОН | → | СН3-С ≡ СН + 2КВr + 2Н2О, |
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
