| Темы на форуме | Автор | Дата |
При замещении в молекуле бензола одного атома водорода на радикал винил образуется винилбензол, или стирол: С6H5-CH=CH2.
Стирол - бесцветная жидкость с приятным запахом, легче воды, кипит при 145°С. Сохраняет свойства непредельных углеводородов: обесцвечивает бромную воду и раствор перманганата калия (за счет двойной связи в винильном радикале).
Стирол очень легко полимеризуется, образуя полистирол. Особенно ценна его способность к совместной полимеризации с бутадиеном, в результате которой получают различные сорта бутадиенстирольных каучуков (жаро- и морозоустойчивые, прочные на износ, высокоэластичные, устойчивые к маслам). Из них изготовляют шины, ленты для транспортеров, эскалаторов, облегченную микропористую подошву и др.
 admin
admin

Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол и т.д.
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей). Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.
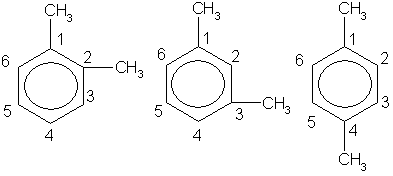
 admin
admin

Ароматическими называются соединения, в молекуле которых имеется циклическая группа атомов с особым характером связи - ядро бензола. Международное название ароматических углеводородов - арены.
Простейшим представителем аренов является бензол С6Н6. Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком Кекуле (1865):
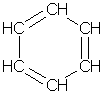
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена. В структурной формуле изображается по три одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
 admin
admin

Задача 1. С помощью каких химических реакций можно очистить пропан от примеси пропена?
Задача 2. Этиленовый углеводород массой 7,0 г присоединяет 2,24 л (н.у.) бромоводорода. Определите молярную массу и строение этого углеводорода, если известно, что он является цис-изомером.
Задача 3. Сколько существует индивидуальных веществ состава С3Н5Сl. обесцвечивающих бромную воду? Приведите структурные формулы молекул этих веществ.
Задача 4. При взаимодействии 11,2 л (н.у.) смеси изомерных углеводородов, представляющих собой газы с плотностью по водороду 21, с бромной водой получено 40,4 г соответствующего дибромпроизводного. Определите строение этих углеводородов и содержание каждого из них в смеси (в % по объему).
Задача 5. При пропускании алкена через избыток раствора перманганата калия масса выпавшего осадка оказалась в 2,07 раза больше массы алкена. Установите формулу алкена.
 admin
admin

 admin
admin

 admin
admin

Задача 1. Даны вещества: циклобутан, ацетилен, гептан, бутен-1, бутин-2, циклогексан, 2,2,3-триметилбутан, бутадиен. Выберите среди них а) три пары изомеров, б) две пары гомологов.
Задача 2. Напишите структурную формулу 2,2,5,5-тетраметилгексана. Напишите формулу его изомера, имеющего в качестве заместителей при основной цепи только этильные радикалы.
Задача 3. Напишите общую молекулярную формулу гомологического ряда нитрофенола. Приведите структурную формулу одного из членов ряда, содержащего 11 атомов водорода в молекуле.
Задача 4. Определите общую формулу гомологического ряда углеводородов, имеющих одну двойную связь, две тройные связи и три цикла. Сколько химических связей содержит молекула этого ряда, в состав которой входят n атомов углерода?
 admin
admin

Молекула органического соединения представляет собой совокупность атомов, связанных в определенном порядке, как правило, ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности. Величины электроотрицательностей в значительной степени определяют такие важнейшие характеристики связи, как полярность и прочность (энергия образования). В свою очередь, полярность и прочность связей в молекуле, в значительной степени, определяют возможности молекулы вступать в те или иные химические реакции.
Электроотрицательность атома углерода зависит от состояния его гибридизации. Это связано с долей s-орбитали в гибридной орбитали: она меньше у sp3- и больше у sp2- и sp-гибридных атомов.
Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается, в основном, через систему ковалентных связей, с помощью так называемых электронных эффектов.
Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.
Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой "дельта" (d). Атом, "оттягивающий" электронную плотность s-связи в свою сторону, приобретает отрицательный заряд d-. При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по s-связи соответственно будет иметь равный по величине дефицит электронной плотности, т.е. частичный положительный заряд d+, будет называться электронодонором.
 admin
admin

Чаще всего органические реакции классифицируют по типу разрыва химических связей в реагирующих частицах. Из их числа можно выделить две большие группы реакций — радикальные и ионные.
Радикальные реакции — это процессы, идущие с гемолитическим разрывом ковалентной связи. При гемолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате гемолитического разрыва образуются свободные радикалы:
X:Y → X.+.Y
Нейтральный атом или частица с неспаренным электроном называется свободным радикалом.
Ионные реакции — это процессы, идущие с гетеролитическим разрывом ковалентных связей, когда оба электрона связи остаются с одной из ранее связанных частиц.
X:Y → X+ + :Y-
В результате гетеролитического разрыва связи получаются заряженные частицы: нуклеофильная и электрофильная.
Нуклеофильная частица (нуклеофил) — это частица, имеющая пару электронов на внешнем электронном уровне. За счет пары электронов нуклеофил способен образовывать новую ковалентную связь.
Электрофильная частица (электрофил) - это частица, имеющая свободную орбиталь на внешнем электронном уровне. Электрофил представляет незаполненные, вакантные орбитали для образования ковалентной связи за счет электронов той частицы, с которой он взаимодействует.
Частица с положительным зарядом на атоме углерода называется карбокатионом.
Согласно другой классификации, органические реакции делятся на термические, являющиеся результатом столкновений молекул при их тепловом движении, и фотохимические, при которых молекулы, поглощая квант света Av, переходят в более высокие энергетические состояния и далее подвергаются химическим превращениям. Для одних и тех же исходных соединений термические и фотохимические реакции обычно приводят к различным продуктам. Классическим примером здесь является термическое и фотохимическое хлорирование бензола — в первом случае образуется хлорбензол, во втором случае — гексахлорциклогексан.
 admin
admin

Среди многообразия органических соединений можно выделить группы веществ, которые сходны по химическим свойствам и отличаются друг от друга на группу СН2.
Соединения, сходные по химическим свойствам, состав которых отличается друг от друга на группу СН2, называются гомологами. Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют гомологический ряд. Группы СН2 называется гомологической разностью.
Примером гомологического ряда может служить ряд предельных углеводородов (алканов). Простейший его представитель - метан СН4. Гомологами метана являются: этан С2Н6, пропан С3Н8, бутан С4H10, пентан С5Н12, гексан С6Н14, гептан С7Н16 и т. д. Формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности.
Состав молекул всех членов гомологического ряда может быть выражен одной общей формулой. Для рассмотренного гомологического ряда предельных углеводородов такой формулой будет СnН2n+2 , где n - число атомов углерода.
Гомологические ряды могут быть построены для всех классов органических соединений. Зная свойства одного из членов гомологического ряда, можно сделать выводы о свойствах других представителей того же ряда. Это обусловливает важность понятия гомологии при изучении органической химии.
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
