| Темы на форуме | Автор | Дата |
Общая характеристика
Углеводороды - простейшие органические соединения, состоящие из двух элементов: углерода и водорода. Предельными углеводородами,
или алканами (международное название), называются соединения, состав которых выражается общей формулой С n Н2n+2, где n - число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы называют также насыщенными углеводородами или парафинами (Термин «парафины» означает «имеющие малое сродство»).Первым членом гомологического ряда алканов является метан СН4. Окончание -ан является характерным для названий предельных углеводородов. Далее следует этан С2Н6, пропан С3Н8, бутан С4Н10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания -ан. Это пентан С5Н12 гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т. д.
В гомологическом ряду наблюдается постепенное изменение физических свойств углеводородов: повышаются температуры кипения и плавления, возрастает плотность. При обычных условиях (температура ~ 22°С) первые четыре члена ряда (метан, этан, пропан, бутан) — газы, с С5Н12 до С16Н34 - жидкости, а с С17Н36 — твердые вещества.
Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры .
Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии sp 3 —гибридизации, а значит, имеют простые (одинарные) связи.
Номенклатура
Названия первых десяти членов ряда предельных углеводородов уже даны. Чтобы подчеркнуть, что алкан имеет неразветвленную углеродную цепь, часто к названию добавляют слово нормальный (н-), например:
СН3—СН2—СН2—СН3 СН3—СН2—СН2—СН2—СН2—СH 2 —СН3
н-бутан н-гептан
(нормальный бутан) (нормальный гептан)
При отрыве атома водорода от молекулы алкана образуются одновалетные частицы, называемые углеводородными радикалами (сокращенно обозначаются буквой R). Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания –ан на -ил. Вот соответствующие примеры:
|
Углеводороды |
|||
|
Метан |
CH 4 |
Гексан |
C 6 H 14 |
|
Этан |
C 2 H 6 |
Гептан |
C 7 H 16 |
|
Пропан |
C 3 H 8 |
Октан |
C 8 H 18 |
|
Бутан |
C 4 H 10 |
Нонан |
C 9 H 20 |
|
Пентан |
C 5 H 12 |
Декан |
C 10 H 22 |
|
Одновалентные радикалы |
|||
|
Метил |
CH 3 - |
Гексил |
C 6 H 13 - |
|
Этил |
C 2 H 5 - |
Гептил |
C 7 H 15 - |
|
Пропил |
C 3 H 7 - |
Октил |
C 8 H 17 - |
|
Бутил |
C 4 H 9 - |
Нонил |
C 9 H 19 - |
|
Пентил (амил) |
C 5 H 11 - |
Децил |
C 10 H 21 - |
Радикалы образуются не только органическими, но и неорганическими соединениями. Так, если от азотной кислоты отнять гидроксильную группу ОН, то получится одновалентный радикал — NO2 , называемый нитрогруппой, и т. д.
При отнятии от молекулы углеводорода двух атомов водорода получаются двухвалентные радикалы. Их названия также производятся от названий соответствующих предельных углеводородов с заменой окончания -ан на -илиден (если атомы водорода оторваны от одного атома углерода) или -илен (если атомы водорода оторваны от двух соседних атомов углерода). Радикал СН2= имеет название метилен.
Названия радикалов используются в номенклатуре многих производных углеводородов. Например: СН3I - йодистый метил, С4Н9Сl -хлористый бутил, СН 2Сl 2 - хлористый метилен, С2Н4Вr 2 - бромистый этилен (если атомы брома связаны с разными атомами углерода) или бромистый этилиден (если атомы брома связаны с одним атомом углерода).
Для названия изомеров широко применяют две номенклатуры: старую - рациональную и современную - заместительную, которую также называют систематической или международной (предложена Международным союзом теоретической и прикладной химии ИЮПАК).
По рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы. Если в формуле одинаковые радикалы повторяются несколько раз, то их указывают греческими числительными: ди - два, три - три, тетра - четыре, пента - пять, гекса - шесть и т. д. Например:
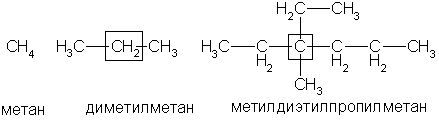
Рациональная номенклатура удобна для не очень сложных соединений.
По заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми. Вот как по этой номенклатуре следует назвать изомеры гексана:
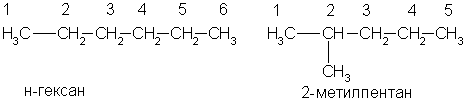
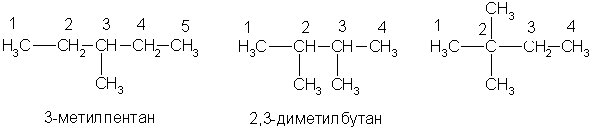
А вот более сложный пример:
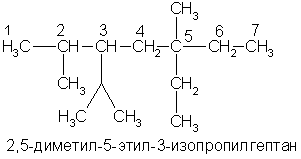
Как заместительная, так и рациональная номенклатура применяются не только для углеводородов, но и для других классов органических соединений. Для некоторых органических соединений используются исторически сложившиеся (эмпирические) или так называемые тривиальные названия (муравьиная кислота, серный эфир, мочевина и др.).
При написании формул изомеров легко заметить, что атомы углерода занимают в них неодинаковое положение. Атом углерода, который связан только с одним атомом углерода в цепи, называется первичным, с двумя - вторичным, с тремя - третичным, с четырьмя - четвертичным. Так, например, в последнем примере атомы углерода 1 и 7 - первичные, 4 и 6 - вторичные, 2 и 3 - третичные, 5 - четвертичный. Свойства атомов водорода, других атомов и функциональных групп зависят от того, с каким углеродным атомом они связаны: с первичным, вторичным или третичным. Это всегда надо учитывать.
Получение. Свойства.
Физические свойства. В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — газы. Нормальные алканы от пентана до гептадекана (C5 — C17) — жидкости, начиная с С18 и выше — твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Основные природные источники алканов — нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
Из синтетических методов получения алканов можно выделить следующие:
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при
нагревании:
| tº. Ni | ||
| СН3-СН=СН2 + Н2 | → | СН3-СН2-СН3, |
СНз-C≡СН + 2Н2 → СН3-СН2-СН3.
2. Получение из галогенпротводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):
С2Н5Br + 2Na + Br-C2H5 → C2H5-C2H5 + 2NaBr.
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:
| t° | ||
| CH3COONa + NaOH | → | СН4↑ + Na2CO3. |
4.Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
С + 2Н2 → СН4.
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:
Аl4С3 + 12Н2О = ЗСН4↑ + 4Аl(ОН)3.
Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями - перманганатомкалия KMnО4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью s-связей С-С и С-Н, а также их неполярностью. Неполярные связи С-С и С-Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ, substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:
<> <>| Сl2 | Сl2 | Сl2 | Сl2 | |||||||
| СН4 | → | СН3Сl | → | СН2Сl2 | → | СНСl3 | → | ССl4 | (*) | |
| -HCl | -HCl | -НСl | -HCl |
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а) инициирование цепи:
| hv | ||
| Сl2 | → | 2Сl· |
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl·+ СН4→НСl + СН3·
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3· + Сl2→СН3Сl + Сl·
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl· + Cl· → Сl2, СН3· + СН3· → С2Н6, СН3· + Cl· → СН3Сl·
Суммарное уравнение реакции:
| hv | ||
| СН4 + Сl2 | → | СН3Сl + НСl. |
Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов CH2Cl2, CHCl3, ССl4 по схеме (*).
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.И. Семенова (1896-1986).
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:
| t ° | ||
| CH3-CH3 + HNO3 | → | CH3-CH2-NO2 + H2O. |
При радикальных реакциях (галогенирование, нитрование) в первую очередь замешаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем — вторичного (390 кДж/моль) и только потом — первичного (415 кДж/моль).
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
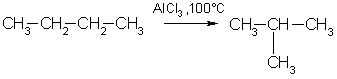
4. Крекинг — это гемолитический разрыв связей С-С, который протекает при нагревании и под действием катализаторов.
При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
C8H18 → C4H10 + С4Н8,
2СН4 → С2Н2 + ЗН2,
С2Н6 → С2Н2 + 2Н2.
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
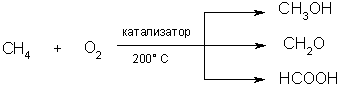 |
Мягкое каталитическое окисление бутана кислородом воздуха - один из промышленных способов получения уксусной кислоты:
t°
2C4H 10 + 5O2 → 4CH3COOH + 2Н2О .
кат
На воздухе алканы сгорают до СО2 и Н2О:
СnН2n+2 + (Зn+1)/2О2 = nСО2 + (n+1)Н2О.
Своё Спасибо, еще не выражали..
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
