| Темы на форуме | Автор | Дата |
Общая характеристика
Анилин (фениламин) С6Н5NН2 — родоначальник класса ароматических аминов, в которых аминогруппа непосредственно связана с бензольным кольцом. Эта связь приводит к важным последствиям.
Неподеленная электронная пара атома азота взаимодействует с p-электронной системой бензольного кольца. Данное взаимодействие можно описать следующими предельными (или резонансными) структурами:
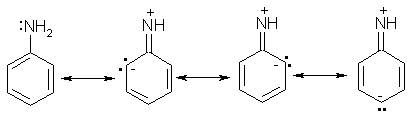
Молекула анилина представляет собой среднее между изображенными четырьмя структурами. Этот факт противоречит одному из положений теории А.М.Бутлерова, согласно которому каждая молекула описывается единственной структурой.
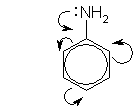
Эти структурные формулы показывают, что электронная пара азота втягивается в бензольное кольцо, при этом на атоме азота появляется частичный положительный заряд, и основные свойства аминогруппы уменьшаются. В бензольном кольце, напротив, электронная плотность увеличивается, причем наиболее сильно — в положениях 2, 4 и 6 (орто- и пара-) по отношению к аминогруппе.
Приведенные выше структурные формулы можно объединить в одну, в которой смещение электронной плотности (+M-эффект группы NH2) изображено стрелками:
Физические свойства. Анилин - бесцветная маслянистая жидкость, немного тяжелее воды, мало растворима в воде, растворима в этиловом спирте и в бензоле.
Получение
Основной способ получения анилина — восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350 °С на никелевомили медном католизаторе:
C6H5NO2 + 3Н2 → C6H5NH2 + 2Н2О.
В лаборатории для этой цели используют цинк в кислой среде:
С6Н5NО2 + 3Zn + 7HCl → C6H5NH3Cl + 3ZnCl2 + 2Н2О
или алюминий в щелочной среде:
C6H5NO2 + 2Al + 2NaOH + 4Н2О → C6H5NH2 + 2Na[Al(OH)4].
В последних двух реакциях реальный восстановитель — водород в момент выделения.
Химические свойства
1. Анилин - гораздо более слабое основание, чем алифатические амины (Kb = 5,2.10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фениламмония C6H5NH3+, которые хорошо растворимы в воде, но нерастворимы в неполярных органических растворителях:
С6Н5NН2 + HCl → С6Н5NН3Сl.
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:
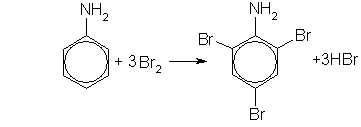
2,4,6-триброманилин
С концентрированной азотной кислотой анилин реагирует со взрывом, поэтому непосредственное нитрование осуществить не удается. Можно, однако, на время реакции защитить аминогруппу, если перед нитрованием превратить ее в амидную группу - NН-СО-СН3 действием уксусного ангидрида, а после нитрования гидролизовать амид с образованием исходной аминогруппы. Данная последовательность реакций описывается схемой:
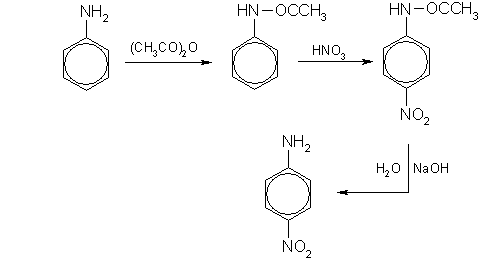
В этих реакциях образуется также небольшое количество орто-нитроанилина.
3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C6H5N2+:
C6H5NH2 + NaNO2 + 2HCl → [C6H5-N≡N]+Cl- + NaCl + 2H2O.
Диазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы легко замещаться на другие функциональные группы, эти соединения широко используются в органических синтезах. Во многих случаях можно не выделять диазосоединения в кристаллическом виде, а использовать их свежеприготовленные растворы.
4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это — качественная реакция на анилин.
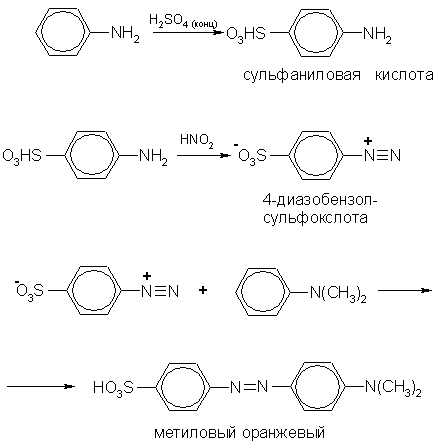
Применение. Основная область применения анилина — синтез красителей и лекарственных средств. В качестве примера приведем схему синтеза красителя метилового оранжевого (кислотно-основного индикатора):
Сказали спасибо: koval7788.
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
