| Темы на форуме | Автор | Дата |
Примеры решения задач
Задача 1. Напишите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой. Составьте: схемы электронного и электронно-ионного баланса.
Решение. НNО3 - сильный окислитель, поэтому сера будет окисляться до максимальной степени окисления S+6, а железо до Fe+3, при этом НNО3 может восстанавливаться до NO или NO2. Рассмотрим случай восстановления до NО2.
FеS2 + НNO3(конц) → Fе(NO3)3 + Н2SО4 + NО2.
Где будет находиться Н2О (в левой или правой части), пока неизвестно.
Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается схемой:
N+5 + e → N+4
В полуреакцию окисления вступают сразу два элемента - Fe и S. Железо в дисульфиде имеет степень окисления +2, а сера -1. Необходимо учесть, что на один атом Fе приходится два атома S:
Fe+2 – e → Fe+3
2S- - 14e → 2S+6.
Вместе железо и сера отдают 15 электронов. Полный баланс имеет вид:
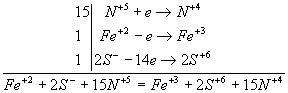
15 молекул НNО3 идут на окисление FеS2, и еще 3 молекулы НNО3 необходимы для образования Fе(NО3)3:
FеS2 + 18НNО3 → Fе(NО3)3 + 2Н2SО4 + 15NО2 .
Чтобы уравнять водород и кислород, в правую часть надо добавить 7 молекул Н2О:
FeS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
Используем теперь метод электронно-ионного баланса. Рассмотрим полуреакцию окисления. Молекула FеS2 превращается в ион Fе3+ (Fе(NО3)3 полностью диссоциирует на ионы) и два иона SO42- (диссоциация H2SO4):
FeS2 → Fe3+ + 2SO24-.
Для того, чтобы уравнять кислород, в левую часть, добавим 8 молекул H2O, а в правую – 16 ионов Н+ (среда кислая!):
FeS2 + 8H2O → Fe3+ + 2SO42- + 16H+.
Заряд левой части равен 0, заряд правой +15, поэтому FеS2 должен отдать 15 электронов:
FеS2 + 8Н2О - 15е → Fе3+ + 2SО42- + 16Н+.
Рассмотрим теперь полуреакцию восстановления нитрат-иона:
NO-3 → NO2.
Необходимо отнять у NО3- один атом О. Для этого к левой части добавим 2 иона Н+ (кислая среда), а к правой — одну молекулу Н2О:
NО3- + 2Н+ → NО2 + Н2О.
Для уравнивания заряда к левой части (заряд +1) добавим один электрон:
NО3- + 2Н+ + е → NO2 + Н2О.
Полный электронно-ионный баланс имеет вид:
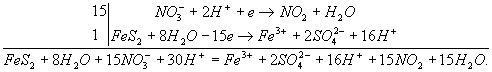
Сократив обе части на 16Н+ и 8Н2О, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
FеS2 + 15NО3- + 14Н+ = Fе3+ + 2SО42- + 15NО2 + 7Н2О.
Добавив в обе части уравнения соответствующее количество ионов по три иона NО3- и Н+, находим молекулярное уравнение реакции:
FеS2 + 18НNО3(конц) = Fе(NО3)3 + 2Н2SО4 + 15NО2 + 7Н2О.
Задача 2. Напишите уравнения реакций, протекающих в водной среде:
а) Na2SО3 + КМnО4 + Н2SО4 → X + …
б) Х + КОН → ...
Решение.
а) Перманганат калия в кислой среде восстанавливается в соль марганца (II), а сульфит натрия окисляется до сульфата натрия:
5Nа2SО3 + 2КМnО4 + ЗН2SО4 = 5Nа2SО4 + К2SО4 + 2МnSО4 + ЗН2О.
б) Из продуктов реакции а) только сульфат марганца (II) (вещество X) реагирует со щелочью в водном растворе:
MnSО4 + 2КОН = Мn(ОН)2↓+ К2SО4.
Задача 3. Электролиз 400 г 8,5%-ного раствора нитрата серебра продолжали до тех пор, пока масса раствора не уменьшилась на 25 г. Вычислите массовые доли соединений в растворе, полученном после окончания электролиза, и массы веществ, выделившихся на инертных электродах.
Решение. При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg+, а на аноде — окисление молекул воды:
Катод: Аg+ + е = Аg.
Анод: 2Н2О - 4е = 4Н+ + О2.
Суммарное уравнение:
4AgNО3 + 2Н2О = 4Ag↓ + 4НNО3 + О2↑.
v(АgNО3) = 400.0,085 / 170 = 0,2 моль. При полном электролитическом разложении данного количества соли выделяется 0,2 моль Аg массой 0,2.108 = 21,6 г и 0,05 моль О2 массой 0,05.32 = 1,6 г. Общее уменьшение массы раствора за счет серебра и кислорода составит 21,6+1,6 = 23,2 г.
При электролизе образовавшегося раствора азотной кислоты разлагается вода:
2H2O = 2Н2↑ + O2↑.
Потеря массы раствора за счет электролиза воды составляет 25 - 23,2 = 1,8 г. Количество разложившейся воды равно: v(Н20) = 1,8/18 = 0,1. На электродах выделилось 0,1 моль Н2 массой 0,1.2 = 0,2 г и 0,1/2 = 0,05 моль О2 массой 0,05.32 = 1,6 г. Общая масса кислорода, выделившегося на аноде в двух процессах, равна 1,6+1,6 = 3,2 г.
В оставшемся растворе содержится азотная кислота: v(НNO3) = v(AgNО3) = 0,2 моль, m(НNО3) = 0,2.63 = 12,6 г. Масса раствора после окончания электролиза равна 400-25 = 375 г. Массовая доля азотной кислоты: ω(НNО3) = 12,6/375 = 0,0336, или 3,36%.
Ответ. ω(НNО3) = 3,36%, на катоде выделилось 21,6 г Аg и 0,2 г Н2, на аноде — 3,2 г О2.
Задача 4. Составить уравнение реакции восстановления Fe3O4 водородом.
Решение. Запишем схему процесса с указанием изменения степеней окисления элементов:
![]()
Составляем электронные уравнения:
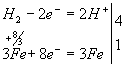
Найденные коэффициенты проставляем в схему процесса, заменяя стрелку на знак равенства:
Fе3О4 + 4Н2 = ЗFе + 4Н2О
Задача 5. Составьте схемы электролиза водных растворов: а) сульфата меди б) хлорида магния; в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
Решение.
а) В растворе сульфат меди диссоциирует на ионы:
СuSО4 ![]() Сu2+ + SO42-
Сu2+ + SO42-
Ионы меди могут восстанавливаться, на катоде в водном растворе. Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды. Схема электролиза:
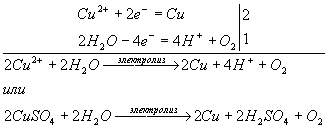
б) Диссоциация хлорида магния в водном растворе:
MgCl2+ ![]() Mg2++2Сl-
Mg2++2Сl-
Ионы магния не могут восстанавливаться в водном растворе (идет восстановление воды), хлорид-ионы — окисляются. Схема электролиза:
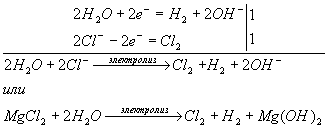
в) Диссоциация сульфата калия в водном растворе:
К2SО4 ![]() 2К+ + SO42-
2К+ + SO42-
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно, на катоде будет протекать восстановление, а на аноде — окисление воды. Схема электролиза:
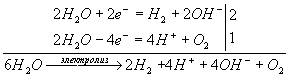
или, учитывая, что 4Н+ + 4ОН- = 4Н2О (осуществляется при перемешивании),
2H2O ![]() 2H2 + O2
2H2 + O2






 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
