| Темы на форуме | Автор | Дата |
Составление уравнений окислительно-восстановительных реакций
Метод электронного балланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Пример 1.
Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:![]()
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь - восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями
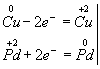
![]()
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Пример 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции:
НCl + МnО2 → Сl2 + MnСl2 + Н2О
Покажем изменение степеней окисления атомов до и после реакции:
![]()
Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО2 — окислитель. Составляем электронные уравнения:
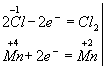
![]()
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НСl + MnO2 → Сl2 + MnСl2 + Н2О
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид
4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
4Н+ + 4Сl- + МnО2 = Сl2 + Мn2+ + 2Сl- + 2Н2О
и после сокращения одинаковых ионов в обеих частях уравнения получим
4Н+ + 2Cl- + MnO2 = Сl2 + Mn2+ + 2Н2О
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции - формулы исходных и полученных веществ:
Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О
Затем покажем изменение степеней окисления атомов до и после реакции:
![]()
Изменяются степени окисления у атомов серы и марганца (Н2S - восстановитель, КМnО4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
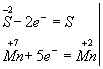
И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2.4 + 3.4 = 20 и в правой части 2.4 + 4 + 8 = 20.
Переписываем уравнение в ионной форме:
5Н2S + 2MnO4- + 6H+ = 5S + 2Мn2+ + 8Н2О
Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Метод полуреакций
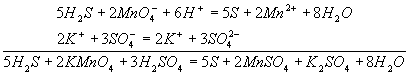 Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
Н2S → S + 2H+
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Н2S - 2е- = S + 2H+
Это первая полуреакция - процесс окисления восстановителя Н2S.
Обесцвечивание раствора связано с переходом иона MnO4- (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4- → Mn2+
В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4- + 8Н+→ Мn2+ + 4Н2О
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4- + 8Н+ + 5e-= Mn2+ + 4Н2О
Это вторая полуреакция - процесс восстановления окислителя, т.е. перманганат-иона
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
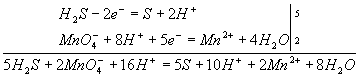
И, сократив на 10Н+, окончательно получим
5Н2S + 2MnO4- + 6H+ = 5S + 2Mn2+ + 8Н2О
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону - анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
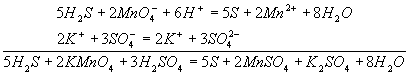
Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе нет ионов ![]() а есть ионы
а есть ионы ![]()
При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.






 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
