| Темы на форуме | Автор | Дата |
Примеры решения задач
Задача 1. Реакция при температуре 50° С протекает за 2 мин 15 с. За сколько времени закончится эта реакция при температуре 70° С, если в данном температурном интервале температурный коэффициент скорости реакции равен 3?
Решение. При увеличении температуры с 50 до 70o С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
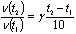
где t2 = 70° С, t1 = 50° С, а v (t2) и v(t1) - скорости реакции при данных температурах. Получаем

т.е. скорость реакции увеличивается в 9 раз.
В соответствии с определением скорость реакции обратно пропорциональна времени реакции, следовательно,
где t(t1) и t(t2) - время реакции при температурах t1 и t2.
Отсюда получаем
Учитывая, что t(t1) = 135 с (2 мин 15 с), определяем время реакции при температуре t2:
Задача 2. В системе
A + B ![]() C, ∆Ho < 0
C, ∆Ho < 0
где А, В и С - газы, установилось равновесие. Какое влияние на равновесную концентрацию вещества С окажут: а) увеличение давления; б) увеличение концентрации вещества А; в) повышение температуры?
Решение.
а) При протекании реакции общее количество газообразных веществ уменьшается с 2 до 1. В соответствии с принципом Ле Шателье повышение давления приведет к смещению равновесия в сторону меньшего количества газообразных веществ (т.е. в сторону образования вещества С), следовательно, [С] увеличится.
б) Увеличение концентрации вещества А приведет к смещению равновесия в сторону образования продукта С, т.е. [С] увеличится.
в) Так как ∆Ho < 0, теплота выделяется, реакция - экзотермическая. Обратная реакция обязательно будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону веществ А и В и [С] уменьшится. Задача 3. Как повлияет увеличение давления на химическое равновесие в обратимой системе Fe3O4 (т) + CO2 (г) Решение. Запишем выражения для скорости прямой (vпр) и обратной (vобр) реакций: vпр = kпр [СО]; vобр = kобр [СO2]. Скорости прямой и обратной реакций не зависят от концентрации твердых веществ. При увеличении давления в 2 раза в такое же число раз увеличится концентрация СО и СО2. Следовательно, скорости прямой и обратной реакций увеличатся в одинаковое число раз и равновесие в системе не сместится. Задача 4. При стандартных условиях теплота полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях? Решение. Реакция сгорания моля черного фосфора имеет вид: Р(ч) + 5/4О2 = 1/2Р2О5 + 722,1 кДж/моль. Этот же процесс можно провести в две стадии: сначала превратить моль черного фосфора в моль белого: P(ч) = Р(б) + Q а затем - сжечь белый фосфор: Р(б) + 5/4О2 = 1/2Р2О5 + 760,1 кДж/моль. По закону Гесса, 722,1 = Q + 760,1, откуда Q = -38 кДж/моль. Ответ. -38 кДж/моль. Задача 5 . Растворение образца цинка в соляной кислоте при 20° С заканчивается через 27 минут, а при 40° С такой же образец металла растворяется за 3 минуты. За какое время данный образец цинка растворится при 55° С? Решение. Растворение цинка в соляной кислоте описывается уравнением: Zn + 2HCl = ZnCl2 + H2↑. Поскольку во всех трех случаях растворяется одинаковое количество образца, то можно считать, что средняя скорость реакции обратно пропорциональна времени реакции. Следовательно, при нагревании от 20° С до 40° С скорость реакции увеличивается в 27/3 = 9 раз. Это означает, что коэффициент γ в уравнении Вант-Гоффа![]() 3FeO (т) + CO2 (г)
3FeO (т) + CO2 (г)
который показывает, во сколько раз увеличивается скорость реакции V при увеличении температуры Т на 10°, равен γ = 3. Значит, при нагревании до 55° С скорость реакции увеличится в 3(55 - 40)10 = 5,2 раза, а время реакции составит 3/5,2 = 0,577 мин, или 34,6 с. Ответ. 34,6 с.






 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
