| Темы на форуме | Автор | Дата |
Энергия активации
Сильное изменение скорости
реакции с изменением температуры объясняет теория активации. Согласно этой теории в химическое взаимодействие вступают только активные молекулы (частицы), обладающие энергией, достаточной для осуществления данной реакции. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, - этот процесс называется активацией. Один из способов активации - увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость.Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации.
Ее определяют опытным путем, обозначают буквой Еa и обычно выражают в кДж/моль. Так, например, для соединения водорода и иода (Н2 + I2 = 2НI) Еа = 167,4 кДж/моль, а для распада иодоводорода (2НI = Н2 + I2) Еа = 186,2 кДж/моль.
Энергия активации Еa зависит от природы реагирующих веществ и служит характеристикой каждой реакции. Эти представления поясняются рисунком: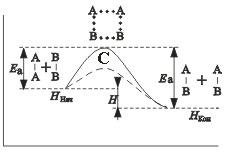
на примере реакции в общем виде А2 + В2 = 2АВ. Ось ординат характеризует потенциальную энергию системы, ось абсцисс - ход реакции: исходное состояние → переходное состояние → конечное состояние. Чтобы реагирующие вещества А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С. На это затрачивается энергия активации Еа, на значение которой возрастает энергия системы. При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом (в точке С), последующий распад которого приводит к образованию конечного продукта АВ. Механизм реакции можно изобразить схемой
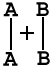 |
 |
 |
 |
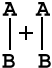 |
|
| исходные реагенты (начальное состояние системы) | активированный комплекс (переходное состояние) | продукты реакции (конечное состояние системы) |
Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая. Примером эндотермической реакции служит обратный процесс - образование из вещества АВ веществ А2 и В2: 2АВ = А2 + В2. В этом случае процесс протекает также через образование активированного комплекса А2В2, однако энергия активации больше, чем для прямого процесса: Еа = Еа + ∆H (∆H - тепловой эффект реакции). Для протекания эндотермических реакций требуется подвод энергии извне.
Как видно из рисунка

разность энергий конечного состояния системы (Hкон) и начального (Hнач) равна тепловому эффекту реакции:
∆H = Hкон - Hнач.
Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой, но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью (практически мгновенно).






 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
