| Темы на форуме | Автор | Дата |
Электронные конфигурации атомов
В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2 другой c ms = -1/2 . Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml.
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml=0 и ms может иметь произвольные значения: +1/2 или -1/2 . Мы видим, что если n = 1, таких электронов может быть только два.
В общем случае, при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l, принимающим значения от 0 до n 1. При заданных n и l может быть (2l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l и ml соответствуют два разных значения проекции спина ms.
Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой
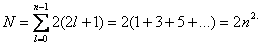
Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т.д.
Рассмотрим, например, атом гелия. В атоме гелия 2He квантовые числа n = 1, l = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число ms отличается. Проекции спина электронов гелия могут быть ms = +1/2 или ms = -1/2 . Строение электронной оболочки атома гелия 2Не можно представить как 1s2 или, что то же самое
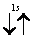
Заметим, что в одной квантовой ячейке согласно принципу Паули никогда не может быть двух электронов с параллельными спинами.
Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s:
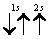
При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных p-орбиталях:
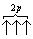
В этом случае суммарный спин равен 3/2 , поскольку его проекция равна ms = +1/2-1/2+1/2=1/2 . Эти же три электрона не могут быть расположены таким образом:
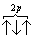
потому что тогда проекция суммарного спина ms = +1/2-1/2+1/2=1/2 . По этой же причине именно так, как приведено выше, расположены электроны в атомах углерода, азота и кислорода.
Рассмотрим далее электронные конфигурации атомов следующего третьего периода. Начиная с натрия 11Nа, заполняется третий энергетический уровень с главным квантовым числом n = 3. Атомы первых восьми элементов третьего периода обладают следующими электронными конфигурациями:
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd - 4р – 5s и т.д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом
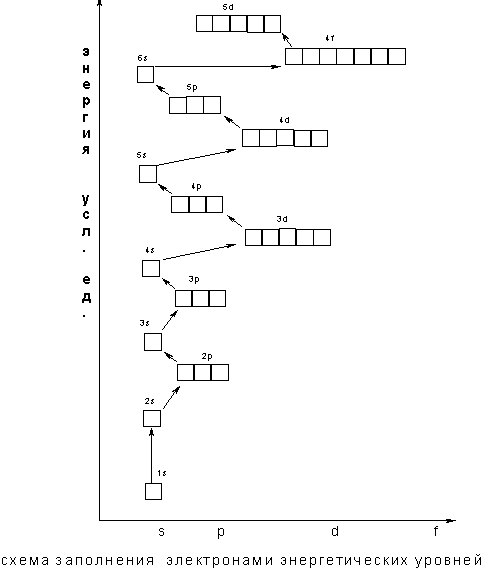
Следовательно, согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен
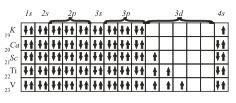 Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd.
Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd. 
Следующий элемент этого периода — 24Сr. На основании трех основных положений — принципа Паули, правила Гунда и принципа наименьшей энергии — его электронную конфигурацию можно представить так
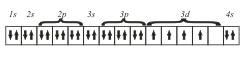
хотя на самом деле у атома 24Cr обнаружены некоторые аномалии и действительная его электронная конфигурация несколько иная (как и еще у одного элемента 29Сr).
Для атомов Mn, Fe, Со и Ni электронные конфигурации будут следующие
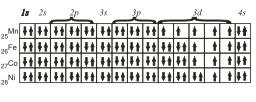
Наконец, последние восемь элементов четвертого периода имеют конфигурации
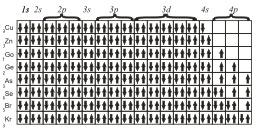
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.






 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
