| Темы на форуме | Автор | Дата |
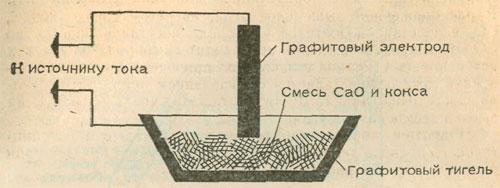
В химическом кружке при наличии маленькой электродуговой печи, а также требуемого источника тока можно получить немного карбида кальция. В маленький графитовый тигель или в углубление, выдолбленное в толстом угольном электроде, поместим смесь равных (по массе) количеств оксида кальция (негашеной извести) и кусочков кокса размером с булавочную головку. Избыточный уголь при действии кислорода воздуха сгорит. Схема опыта показана на рисунке.
 admin
admin

Докажем присутствие в этине (ацетилене) ненасыщенной связи с помощью реактива Байера или бромной воды. Для этого поместим реактив в пробирку и пропустим через него этин. Его мы получим в другой пробирке из нескольких кусочков карбида кальция. Эту пробирку закроем резиновой пробкой с двумя отверстиями. В одно из них заранее вставим стеклянную трубку с изогнутым концом - он должен быть погружен в пробирку с реактивом. В другое отверстие вставим капельную воронку и кран ее вначале закроем. Можно взять вместо нее и простую стеклянную воронку, заменив кран зажимом, как при получении метана. В воронку нальем воду неосторожно приоткрывая кран, будем медленно, по каплям, добавлять ее к карбиду.
 admin
admin

Система прежде всего! Вступая в мир органической химии, можно сразу же заблудиться, если предварительно не ознакомиться с классами органических соединений и основами языка органической химии. В самом деле, ведь большинство органических веществ можно разделить на группы со сходным строением и подобными свойствами. Химики, используя латинские и греческие корни, и, кроме того, в значительной мере выдуманную ими абракадабру, создали такую хорошо продуманную систему названий, которая сразу же подсказывает специалисту, к какому классу следует отнести те или иные вещества.
Одна беда: наряду с названиями по единым правилам международной номенклатуры для многих соединений до сих пор употребляются их собственные названия, связанные с происхождением этих соединений, их наиболее примечательными свойствами или другими факторами. Поэтому для многих соединений в этой книге придется приводить несколько названий.
Мы уже знакомы с насыщенными и ненасыщенными углеводородами. Насыщенные углеводороды называются алканами, ненасыщенные с двойной связью — алкенами, и с тройной — алкинами. Нам известно, что эти углеводороды, если расположить их в порядке увеличения числа атомов углерода, образуют гомологические ряды.
Наряду с углеводородами большое значение имеют такие органические соединения, которые содержат еще кислород. Рассмотрим сначала три ряда кислородсодержащих органических соединений:
алканолы (спирты)
алканали (альдегиды)
алкановые кислоты (прежнее название — карбоновые кислоты)
 admin
admin

При сухой перегонке древесины мы уже получили несколько капель неочищенного метанола (метилового спирта). В настоящее время подавляющая часть метанола получается путем синтеза из водяного газа:
СО + 2Н2 ↔ СН3ОН
Составные части водяного газа соединяются с образованием метанола. Кроме того, в незначительном количестве образуются и высшие спирты. Этот процесс требует температуры 400 °С, давления 200 ат и ускоряется в присутствии оксидных катализаторов.
Метанол служит растворителем и промежуточным продуктом в производстве красителей. Но главным потребителем его является производство пластмасс, для которого нужны большие количества метаналя (формальдегида). Метаналь же получается при окислении метанола кислородом воздуха. В промышленности смесь паров метанола и воздуха при 400 °С пропускают над медным или серебряным катализатором.
Чтобы смоделировать этот процесс, согнем в спираль кусочек медной проволоки диаметром 0,5—1 мм и щипцами внесем его в несветящуюся зону пламени горелки Бунзена.
Проволока раскаляется и покрывается слоем оксида меди (II). Поместим полученный нами раньше метанол (10 капель) в достаточно широкую пробирку и опустим в него раскаленную медную спираль.
Вследствие нагревания метанол испаряется и под влиянием катализатора — меди — соединяется с кислородом с образованием метаналя (мы узнаем его по характерному резкому запаху). При этом поверхность медной проволоки восстанавливается. Реакция происходит с выделением тепла. При больших количествах паров метанола и воздуха медь остается разогретой до тех пор, пока реакция не завершится. Отметим, что метанол очень ядовит! Поэтому не будем проводить опыт с большими количествами. Даже маленький глоток метанола может вызвать полную потерю зрения, а иногда и смерть.
Поэтому метанол всегда нужно хранить так, чтобы ни в коем случае никто не мог по сшибке выпить его. Впрочем, метанол наряду с другими соединениями специально добавляют в малом количестве к спирту, который используется для горения, с целью его денатурации. Поэтому денатурированный спирт тоже ядовит!
 admin
admin

Следующие опыты проведем с продажным формалином. Формалин — это 35—40 %-ный раствор метаналя (формальдегида) в воде. Обычно он содержит еще малое количество непрореагировавшего ядовитого метанола. Сам метаналь вызывает свертывание белков и, следовательно, тоже является ядом.
Проведем ряд простых опытов. В пробирке или маленькой колбочке упарим несколько миллилитров формалина. Получится белая труднорастворимая масса, пробу которой мы затем нагреем в другой пробирке. При этом она улетучится, и по запаху чувствуется, что опять образовался метаналь. В чистом состоянии метаналь представляет собой газ, который при обычном давлении и —19 °С превращается в жидкость. Уже на холоду и в еще большей степени при легком нагревании или в присутствии кислот метаналь начинает полимеризоваться. При этом множество его молекул соединяется друг с другом и образует длинные цепи параформа:
...СH2—O—CH2— O—CH2— O—CH2—O…
Сильное нагревание приводит к обратному превращению параформа в метаналь.
Полимеризация характерна для многих алканалей и свидетельствует о присутствии в них ненасыщенной связи. Реакции полимеризации лежат в основе получения многих пластмасс. Метаналь постепенно полимеризуется и в растворе с образованием все более длинных цепных молекул. Такой полимеризованный формалин можно регенерировать путем нагревания параформа и поглощения выделяющихся при этом паров метаналя водой.
Метаналь и другие алканали (альдегиды) дают с так называемым реактивом Шиффа характерную цветную реакцию, которая может служить для их распознавания. Приготовим реагент, взяв на кончике скальпеля немного красителя фуксина и растворив его в нескольких миллилитрах теплой дистиллированной воды. К этому раствору порциями, до обесцвечивания, будем добавлять водный раствор сернистой кислоты. Нальем в пробирку несколько миллилитров полученного таким образом реактива, добавим несколько капель раствора метаналя и перемешаем. Вскоре появится фиолетовое окрашивание. Проведя ряд опытов с все более разбавленным раствором метаналя, мы можем убедиться в чувствительности этой качественной реакции.
Нальем в пробирку несколько миллилитров реактива Фелинга, который можно приготовить, смешав равные количества следующих исходных растворов:
Исходный раствор Фелингат№ 1: 7 г сульфата меди (II) в 100 мл дистиллированной воды.
Исходный раствор Фелинга №2: 37 г сегнетовой соли и 10 г едкого натра в 100 мл дистиллированной воды.
 admin
admin

Метановая (муравьиная) кислота — простейшая органическая кислота. В технике ее получают присоединением оксида углерода к гидроксиду натрия под давлением. По уравнению
NaOH + СО → HCOONa
при этом образуется натриевая соль муравьиной кислоты — метанат натрия, или формиат натрия. В Германии метановая кислота производится этим методом на химических заводах в Финовтале и Биттерфсльде. Она служит промежуточным продуктом при получении других соединений и находит применение в текстильном и кожевенном производстве. Метановая кислота обладает сильным дезинфицирующим и консервирующим действием, поэтому ее используют для предохранения от порчи пищевых продуктов и силоса.
Некоторые применяемые при силосовании препараты представляют собой, в основном, раствор метановой кислоты. С метановой кислотой, приобретенной в магазине, проведем следующие опыты. (Осторожно! Концентрированная метановая кислота ядовита и разъедает кожу!)
В пробирку нальем 5 мл разбавленной серной кислоты и добавим раствор перманганата калия — столько, чтобы жидкость была сильно окрашена. После этого добавим еще 5 мл приблизительно 80 % метановой кислоты. При нагревании смесь обесцвечивается вследствие восстановления перманганата до сульфата марганца (II). При этом метановая кислота окисляется до диоксида углерода и воды.
В последующих пробирочных опытах проверим, растворяются ли в 60 % метановой кислоте магний, цинк, железо и никель. Активные металлы реагируют с метановой и другими органическими кислотами с образованием солей и выделением водорода. Таким образом, органические кислоты ведут себя совершенно аналогично неорганическим, но, как правило, они слабее.
Концентрированная серная кислота и некоторые катализаторы разлагают метановую кислоту на оксид углерода СО и воду. Нагреем 1 мл безводной метановой кислоты с избытком концентрированной серной кислоты в пробирке, закрытой резиновой пробкой, в которую вставлена стеклянная трубка. Из этой трубки улетучивается газ, который при поджигании горит бледно-голубым пламенем. Это ядовитый оксид углерода (угарный газ), с которым мы уже знакомы. Из-за связанной с этим опасности опыт нужно проводить в вытяжном шкафу или на открытом воздухе.
В заключение надо еще отметить, что метановая кислота и ее соли часто встречаются в природе. Как видно уже по ее второму названию (муравьиная), эта кислота входит в состав ядовитых выделений муравьев. Кроме того, она обнаружена в выделениях пчел, в крапиве и т. д.
 admin
admin

Итак, мы познакомились с метанолом, метаналем и метановой кислотой. Подобные им соединения, содержащие два атома углерода, имеют наибольшее значение в технике.
Этанол (этиловый спирт), который обычно называют просто спиртом, образуется при так называемом спиртовом брожении. Многие виды Сахаров, а также продукт осахаривания крахмала в присутствии солода расщепляются под действием микроскопически маленьких дрожжевых грибков с образованием спирта и углекислого газа. Каждый, кто хоть раз видел, как бродит фруктовый сок, наблюдал интенсивное выделение углекислого газа из отводной трубки. А то, что в полученном чине действительно содержится спирт, легко заметить по поведению человека, который это вино выпьет.
Поскольку спиртовое брожение может происходить самопроизвольно, разбавленный спирт известен людям с древнейшего времени как возбуждающий напиток. О губительных же последствиях пьянства едва ли нужно говорить. В особенности молодежи следует полностью отказаться от употребления спиртных напитков.
Содержание спирта при брожении растворов сахара и фруктовых соков колеблется в широких пределах. Однако, поскольку при высокой концентрации спирта дрожжевые грибки не могут существовать, путем брожения можно получить не более чем 15 %-ный спирт. Водку и более концентрированный спирт получают из разбавленных растворов путем перегонки. Проведение такой перегонки по закону разрешается только на государственных ликерно-водочных заводах. Получение же хотя бы самого малого количества спирта частными лицами, пусть даже для химических опытов, строго запрещено законом.
Пищевой спирт и спирт для косметических целей вырабатывается только из зерна. Крахмал сначала превращают в сахар, который затем сбраживают в спирт. Технический спирт получается в больших количествах в результате брожения сульфитного щелока, то есть из отходов целлюлозно-бумажного производства. Все большая часть технического спирта — незаменимого растворителя и исходного вещества в органическом синтезе — в настоящее время производится синтетическим путем из карбида кальция через этин и этаналь.
Чистый спирт поступает в продажу под названием спирт-ректификат. Он содержит 4—6 % воды. Так как ректификат дорого стоит, мы используем его лишь в немногих опытах. В тех случаях, когда это не будет оговорено, удовольствуемся намного более дешевым денатуратом, который, как нам хорошо известно, применяется в качестве горючего. Это тоже 95 %-ный спирт, но, чтобы он не был пригоден для питья, к нему добавлены ядовитые и имеющие неприятный вкус или запах вещества (метанол, пиридин, эфир фталевой кислоты).
 admin
admin

При окислении этанола образуется этаналь (уксусный альдегид) и далее этановая кислота (уксусная кислота). Сильные окислители сразу превращают этаналь в уксусную кислоту. К тому же результату приводит и окисление кислородом воздуха под влиянием бактерий. Мы легко сможем убедиться в этом, если немного разбавим спирт и оставим его на некоторое время в открытой чашке, а затем проверим реакцию на лакмус. Для получения столового уксуса до сих пор используют, в основном, уксуснокислое брожение спирта или низкосортных вин (винный уксус).
Для этого спиртовый раствор при интенсивной подаче воздуха медленно пропускают через опилки из буковой древесины. В продажу поступает 5 % или 30 %-ный столовый уксус или так называемая уксусная эссенция, содержащая 40% уксусной кислоты. Для большинства опытов она нам подойдет. Лишь в некоторых случаях понадобится безводная (ледяная) уксусная кислота, которая относится к числу ядов. Ее можно купить в аптеке или магазине химических реактивов. Она уже при 1,6 °С затвердевает в кристаллическую массу, похожую на лед. Синтетическим путем уксусную кислоту получают из этина через этаналь.
Неоднократно упоминавшийся этаналь, или уксусный альдегид,— важнейший промежуточный продукт в химической технологии, основанной на использовании карбида кальция. Его можно превратить в уксусную кислоту, спирт или же в бутадиен — исходное вещество для получения синтетического каучука. Сам этаналь производится в промышленности путем присоединения воды к этину. В Германии на комбинате синтетического бутадиенового каучука в Шкопау этот процесс осуществляется в мощных реакторах непрерывного действия.
Сущность процесса заключается в том, что этин вводится в нагретую разбавленную серную кислоту, в которой растворены катализаторы — соли ртути и другие вещества. Поскольку соли ртути очень ядовиты, мы не будем сами синтезировать этаналь из этина. Выберем более простой способ — осторожное окисление этанола.
Нальем в пробирку 2 мл спирта (денатурата) и добавим 5 мл 20 %-ной серной кислоты и 3 г тонкоизмельчениого бихромата калия. Затем быстро закроем пробирку резиновой пробкой, в которую вставлена изогнутая стеклянная трубка. Смесь нагреем малым пламенем до кипения и выделяющиеся при этом пары пропустим через ледяную воду. Образующийся этаналь растворяется в воде, и его можно обнаружить с помощью описанных выше реакций для определения алканалей. Кроме того, раствор проявляет кислую реакцию, потому что окисление легко идет дальше с образованием уксусной кислоты.
 admin
admin

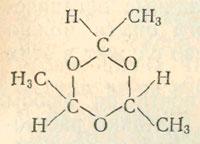
Помимо описанных выше качественных реакций, мы можем провести с малыми количествами этаналя ряд других опытов. В пробирке к 1—2 мл этаналя осторожно добавим (в защитных очках и на расстоянии от себя) с помощью стеклянной палочки 1 каплю концентрированной серной кислоты. Начинается бурная реакция. Как только она затихнет, разбавим реакционную смесь водой и встряхнем пробирку. Выделяется жидкость, которая в отличие от этаналя не смешивается с водой и кипит только при 124 °С. Она получается в результате соединения трех молекул этаналя с образованием кольца:
 admin
admin

В наши дни органические растворители можно найти в любом доме. Кому не приходилось пятновыводителем удалять пятна жира или смолы с одежды? Все лаки, многие клеи, например резиновый, также содержат различные органические растворители. При наличии некоторого опыта можно уже по запаху сказать, какое именно вещество служит в этих смесях растворителем.
Органические растворители требуются почти на любом производстве. Жиры и масла извлекают из растений растворителями. Производство пластмасс, текстильная и лакокрасочная промышленность потребляют растворители в огромных количествах. Так же обстоит дело в производстве лекарственных препаратов и косметики, во многих других отраслях хозяйства.
С некоторыми главными растворителями, например бензином и спиртом, многим наверняка приходилось встречаться. При оценке растворителя играют роль многие факторы. Прежде всего, конечно, важно, какие вещества в нем хорошо растворяются. Так, в спирте прекрасно растворяются многие смолы, лекарственные и косметические средства, тогда как жиры и парафин растворяются в нем очень плохо. Кроме того, при сопоставлении растворителей существенную роль играют их горючесть, температура кипения, токсичность и, не в последнюю очередь, стоимость.
Следующие опыты проведем с несколькими соединениями, которые особенно часто применяются в качестве растворителей.
 admin
admin







 Подготовка к ГИА и ВПР
Подготовка к ГИА и ВПР
