Предельные алифатические амины
19-02-2010, 18:10. Разместил: admin
Строение. Номенклатура
Амины — органические соединения, которые рассматривают как производные аммиака, в котором атомы водорода (один, два или три) замешены на углеводородные радикалы. Амины делятся на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал:
| |
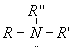 |
|
| первичные | вторичные | третичные |
| амины | амины | амины |
Существуют также органические аналоги солей аммония – это четвертичные соли типа [R4N]+Cl-.
В зависимости от природы радикалов, амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими или смешанными.
Предельные алифатические амины
Общая формула предельных алифатических аминов СnН2n+3N.
Строение. Атом азота в молекулах аминов находится в состоянии sp3-гибридизации. Три из четырех гибридных орбиталей участвуют в образовании σ-связей N-C и N-H, на четвертой орбитали находится неподеленная электронная пара, которая обусловливает основные свойства аминов. Названия аминов обычно производят, перечисляя углеводородные радикалы (в алфавитном порядке) и добавляя окончание -амин, например:
Электронодонорные заместители (предельные углеводородные радикалы) увеличивают электронную плотность на атоме азота и усиливают основные свойства аминов, поэтому вторичные амины - более сильные основания, чем первичные, поскольку два радикала создают на атоме азота большую электронную плотность, чем один. В третичных аминах важную роль играет пространственный фактор: три радикала загораживают электронную пару атома азота и затрудняют ее взаимодействие с другими молекулами, поэтому основность третичных аминов меньше, чем первичных или вторичных.
Константы основности аммиака и низших аминов: X + Н2О ![]() ХH+ + ОН-
ХH+ + ОН-
|
Формула |
Название |
Kb |
|
NH3 CH3NH2 (CH3)2NH (CH3)3N |
Аммиак Метиламин Диметиламин Триметиламин |
1,8.10-5 4,4.10-4 5,4.10-4 6,5.10-5 |
Изомерия аминов связана со строением углеродного скелета и положением аминогруппы:
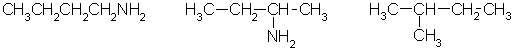
| бутиламин | втор-бутиламин | изобутиламин |
| (бутанамин-1) | (бутанамин-2) | (2-метилпропанамин-1) |
Кроме того, первичные, вторичные и третичные амины, содержащие одинаковое число атомов углерода, изомерны между собой, например:
CH3-CH2-NH2 CH3-NH-CH3
этиламин диметиламин
Номенклатура.
C2H5-NH2 CH3-NH-C2H5 (CH3)3N
этиламин метилэтиламин триметиламин
По другой системе названия первичных аминов строят, исходя из названия родоначального углеводорода и добавляя окончание -амин с указанием номера атома углерода, связанного с аминогруппой.
Физические свойства. Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэтому температуры кипения аминов выше, чем у соответствующих углеводородов.
Амины также образуют слабые водородные связи с водой, поэтому низшие амины хорошо растворимы в воде, по мере роста углеродного скелета растворимость в воде уменьшается. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Получение.
1. Основной способ получения аминов — алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком под давлением:
СН3Сl + 2NН3 → CH3NH2 + NH4Cl.
При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например:
СН3Сl + CH3NH2 → (СН3)2NН2+Сl-,
2CH3Cl + CH3NH2 → (CH3)3NH+Cl- + HCl.
Практически в таких реакциях получается смесь солей первичного, вторичного и третичного аминов, из которой амины выделяют под действием щелочи и разделяют путем перегонки.
2. Первичные амины также получают восстановлением нитросоединений по схеме:
RNO2 + 6[Н] → RNH2 + 2Н2О.
Для восстановления используют сульфид аммония (реакция Зинина), цинк или железо в кислой среде, алюминий в щелочной среде или непосредственно водород в газовой фазе.
3. Первичные амины можно получать восстановлением нитрилов:
R-C≡N + 4[Н] → R-CH2-NH2.
В качестве восстановителя используют алюмогидрид лития LiAlH4.
4. В биологических системах может происходить ферментативное декарбоксилирование аминокислот:
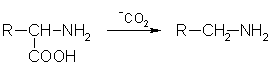
Химические свойства
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак.
Водные растворы аминов имеют щелочную реакцию:
![]()
Константы основности аммиака и низших аминов: X + Н2О ![]() ХH+ + ОН-
ХH+ + ОН-
|
Формула |
Название |
Kb |
|
NH3 CH3NH2 (CH3)2NH (CH3)3N |
Аммиак Метиламин Диметиламин Триметиламин |
1,8.10-5 4,4.10-4 5,4.10-4 6,5.10-5 |
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония:
CH3NH2 + H2SO4 → [CH3NH3]HSO4,
C6H5NH2 + HCl → [C6H5NH3]Cl.
Соли аминов — твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи превращают соли аминов в свободные амины подобно тому, как из солейаммония щелочи вытесняют аммиак.
[CH3NH3]Cl + NaOH ![]() CH3NH2↑ + NaCl + Н2О.
CH3NH2↑ + NaCl + Н2О.
2. Амины — органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами:
Сu2+ + 4CH3NH2 = [Cu(NH2CH3)4]2+.
Неподеленная пара электронов амина в этих комплексах занимает свободную орбиталь во внешнем слое центрального атома, образуя донорно-акцепторную связь.
3. Первичные и вторичные амины реагируют с азотистой кислотой, образующейся при добавлении нитрита натрия к разбавленной соляной кислоте:
NaNO2 + HCl → HNO2 + NaCl.
Первичные амины под действием азотистой кислоты превращаются в спирты:
RNH2 + HNO2 → ROH + N2↑ + H2O.
Промежуточным соединением в этой реакции является неустойчивый ион диазония [R-N≡N]+.
Вторичные амины с азотистой кислотой дают N-нитрозамины — маслянистые жидкости с характерным запахом:
R2NH + HO-N=O → R2N-N=O + Н2О.
Третичные алифатические амины с азотистой кислотой не реагируют. Таким образом, азотистая кислота — реагент, позволяющий определять тип амина.
4. При сгорании аминов образуются углекислый газ, азот и вода:
4CnH2n+3N + (6n+3)O2 = 2N2 + 4nCO2 + (4n+6)Н2О
Применение. Низшие алифатические амины используются для синтеза лекарственных средств, пестицидов и пластмасс.
Вернуться назад